به نام خدا
نام دبیر:آقای سلامی
عنوان:هواکره
نام و نام خانوادگی:فرشاد کهنسال
کلاس:04
دبیرستان:شهید نصیری
هواكره چيست؟
ما بر روي كره زمين و در كره اي از هوا زندگي مي كنيم. به همان شكل كه آبزيان دريا، دور تا دور آن ها را آب فرا گرفته
است، ما را نيز هوا در بر گرفته است. اما ما هوا را نمي بينيم! زماني كه باد مي وزد تنها مي توانيم آن را حس كنيم. اما
واقعاً اين پوشش هوا كه در زير آن، زندگي مي كنيم و آن را هواكره مي ناميم تا كجا ادامه دارد؟ آيا مي توان دقيقاً
ضخامت هواكره را اندازه گيري كرد؟
در پاسخ بايد گفت كه اندازه گيري ضخامت هواكره كاري بس دشوار است. زيرا هواكره يك دفعه به پايان نمي رسد
بلكه كم كم رقيق مي شود و سرانجام ناپديد مي گردد اما مي توان گفت كه:
%99 از هواكره در فاصله 30 كيلومتري از سطح زمين قرار دارد.
هواكره نيز مانند درياها و پوسته زمين، معدني سرشار از مواد شيميايي است و ظرفي براي دور ريختن مواد شيميايي
زايد نيز به شمار مي آيد. ما به هنگام تنفس، سوزاندن سوخت ها و اجراي فرآيندهاي صنعتي گوناگون از برخي گازها
موجود در هواكره استفاده مي كنيم.
ب) هوا، تنفس و ادامه زندگي
دانشمندان معتقدند كه هواكره فعلي، مدت ها پس از پيدايش آب روي زمين تشكيل شده است. اما با اين حال هوا و
آب هر دو، ادامه زندگي گياهان و جانوران را امكان پذير كرده است.
توجه ( 1) : يك نقش مهم هواكره، فراهم آوردن گاز اكسيژن مورد نياز براي تنفس انسان و جانوران است.
توجه ( 2): يك نقش ديگر مهم هواكره، فراهم كردن گاز كربن دي اكسيد مورد نياز براي عمل فتوسنتز گياهان است.
نوع و درصد گازهاي موجود در هواي دم و بازدم
با توجه و دقت به اجزاي سازنده هواي دم و بازدم و تركيب درصد اجزاي آن ها، مي توانيم نتايج مهمي به دست آوريم
كه اكنون آن ها را بررسي مي كنيم.
نتايج:
1 - بيشترين تركيب درصد در هواي دم و بازدم مربوط به نيتروژن مي باشد.
2 - بيشترين اختلاف (تفاوت) تركيب درصد در هواي دم و بازدم مربوط به اكسيژن مي باشد.
3 - كمترين اختلاف (تفاوت) تركيب درصد در هواي دم و بازدم مربوط به نيتروژن
مي باشد.
4 - در هواي بازدم نسبت به هواي دم ميزان نيتروژن و اكسيژن كاهش يافته و بر ميزان كربن دي اكسيد و بخار آب
افزوده گرديده است.
گياهان براي ادامه زندگي خود به يك منبع هميشگي از كربن دي اكسيد نيازمندند، تا از راه فتوسنتز مواد غذايي مورد
نياز خود را بسازند، هواكره اين نياز ضروري آن ها را تأمين مي كند.
توجه: دانشمندان فتوسنتز و تنفس را مكمل يكديگر مي دانند. علت در اين است كه گياهان با عمل فتوسنتز،O2C
هواكره را جذب مي كنند و به جاي آنO2 پس ميدهند. انسان برعكسO2 را از هوا مي گيرد وCO2 پس مي دهد.
سئوال: فرض كنيد كه به طور ميانگين در هر دقيقه 14 بار نفس مي كشيد و در هر بارنيم ليتر هوا را به شش هاي خود
وارد مي كند. الف) با اين حساب در هر دقيقه چند ليتر هوا تنفس مي كنيد؟ ب) در اين مدت چند ليتر گاز اكسيژن به
شش هاي شما وارد مي شود؟
اجزاي سازنده هواكره
اجزاء سازنده هواكره به چهار دسته تقسيم مي شوند.
1 - اجزاء اصلي: بيشترين مقدار هواكره را دو عنصر نيتروژن و اكسيژن تشكيل داده است.
2 - اجزاء جزيي: بعد از اجزاء اصلي دو ماده آرگون و كربن دي اكسيد از بقيه بيشتر ديده مي شوند كه به
اجزاءي جزيي معروفند. (البته لازم به ذكر است مقدار آرگون از كربن دي اكسيد نيز بيشتر است.)
3 - اجزاءي ناچيز هواكره
همانطور كه از نام آ نها مشخص است مقدار آن ها ناچيز است كه از جمله مي توان به نئون(Ne)
آمونياك (NH3)، متان (CH4)، كريپتون(Kr) و هليم(He) اشاره كرد.
4 - اجزاءي بسيار ناچيز هواكره
اجزاي ناچيز ديگري هم وجود دارند كه بر روي هم، فقط در حدود 0001/0 درصد ازحجم هواكره را تشكيل مي دهند.
اين اجزاء عبارتند از: (هيدروژن)، (اوزون)، (گوگرد دي اكسيد)، (نيتروژن دي اكسيد)
زنون) ) ،( كربن مونواكسيد ) و( (نيتروژن مونواكسيد)
توجه:افزون بر چهار حالت گفته شده (گازهاي معرفي شده) نمونه هاي واقعي هوا ممكن است تا بيشتر از 5% رطوبت
داشته باشند. اگر چه در بيشتر مناطق بخار آب از 1 تا 3 درصد در حال تغيير است.
لايه هاي هواكره
به طور كلي هواكره به پنج ناحيه يا پنج قسمت، تقسيم بندي مي شود. اين نواحي از سطح زمين شروع شده و تا نزديك خورشيد ادامه پيدا مي كند. اولين لايه يا نزديك ترين لايه به سطح زمين تروپوسفر نام دارد.
لایه های هواکره
علاوه بر لایههای داخلی زمین، لایههائی از هوا نیز اطراف زمین را احاطه نمودهاند که همراه با زمین دارای گردش وضعی و انتقالی است. این لایههای هوا را به صورت کلی جو (اتمسفر) مینامند که ضخامت آن حداقل 2000 کیلومتر میباشد، سطح کرۀ زمین را پوشانده است و به لحاظ ویژگیهای هر ارتفاعی از نظر ترکیب هوا و خواص آن طبقهبندی شده است که عبارتند از:
1- تروپوسفر که به ضخامت تقریبی 8 الی 15 کیلومتر اطراف زمین را فراگرفته است.
2- استراتوسفر، که بالاتر از تروپوسفر قرار گرفته و تا ارتفاع 45 کیلومتری زمین امتداد داشته و گرد آن گسترده شده است.
3- مزوسفر، که تا ارتفاع تقریبی 80 کیلومتر، امتداد داشته و به ضخامت 35 کیلومتر بالاتر از استراتوسفر گسترده شده است.
4- ترموسفر، که از ارتفاع 80 کیلومتری تا 640 کیلومتری زمین ادامه داشته و به علت اینکه گازهای موجود در این طبقه از جو یونیزه شده و بدون بارالکتریکی میشوند، به این لایه یونیسفر نیز میگویند. در قسمتهای پائینی این طبقه از جو، سنگهای آسمانی سوخته و ازبین میروند.
5- اکسوسفر، این طبقه از جو، از ارتفاع 640 کیلومتر شروع شده و انتهای آن به درستی مشخص نیست ولیکن اثرات آن تا ارتفاع 8000 کیلومتری نیز یافت میشود.









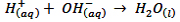
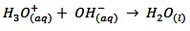
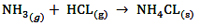

 1xbet is a scam site
1xbet is a scam site شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی
شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی