دیبرستان شهید نصیری
محمد مهدی یوسفی
استاد راهنما:اقای سلامی
موضوع :مدل ارنیوس
پیش دانشگاهی رشته علوم تجربی
سال:93-94
مدل آرنیوس
در دهه ی 1890 یک شیمی دان سوئدی به نام سوانت آرنیوس طی پژوهش هایی روی رسانایی الکتریکی و برقکافت ترکیب های محلول در آب، به مدلی برای اسیدها و بازها دست یافت. در این مطلب به تشریح این مدل تحت عنوان مدل آرنیوس خواهیم پرداخت.

اسید آرنیوس:
ماده ای است که در آب حل می شود و یون هیدروژن (H(aq)+) تولید یا آزاد می کند.

باز آرنیوس:
ماده ای است که در آب حل می شود و یون هیدروکسید (OH(aq)-) تولید یا آزاد می کند.

طبق تعریف آرنیوس از اسید و باز می توان گفت از آنجایی که اکسید نافلزها به هنگام حل شدن در آب، واکنش داده و یون
(H(aq)+) تولید می کنند.، می توان آن ها را اسید آرنیوس به شمار آورد. هم چنین از آنجایی که اکسید فلزها به هنگام حل شدن در آب، واکنش داده و یون (OH(aq)-) تولید می کنند، می توان آن ها را جزو بازهای آرنیوس حساب کرد.
نکته: CO,N2O ,NO سه اکسید نافلزی هستند که انحلال فیزیکی داشته و در آب تولید H(aq)+ نمی کنند، به همین دلیل این سه اکسید را نمی توان جزو اکسیدهای اسیدی محسوب کرد.
واکنش خنثی شدن اسید – باز:
واکنش زیر را بین محلول هیدروکلریک اسید و محلول پتاسیم هیدروکسید مشاهده کنید:

اگر ترکیب های یونی موجود در این واکنش را به صورت تفکیک شده بنویسیم، خواهیم داشت:

توجه: H2O یک ترکیب مولکولی است و نمی توان آن را به صورت تفکیک شده نوشت.
همان طور که مشاهده می کنید یون های K(aq)+ و CL(aq)- در هر دو واکنش وجود دارند و نقشی در انجام واکنش نداشته اند. به چنین یون هایی که عیناً در دو طرف واکنش تکرار می شوند و هیچ پیوند شیمیایی جدیدی ایجاد نمی کنند یون ناظر یا تماشاگر گفته می شود. حال اگر یون های ناظر را از دو طرف حذف کنیم، آنچه که باقی می ماند به صورت زیر است:
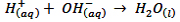
آرنیوس این و اکنش را به عنوان واکنش اصلی خنثی شدن اسید – باز در نظر گرفت.
همان طور که قبلاً گفته شد، H(aq)+ به صورت آزاد نمی تواند وجود داشته باشد چون جذب آب شده و تبدیل به یون هیدرونیم (H3Oaq+) می شود، امُا در زمان آرنیوس هنوز یون هیدرونیم کشف نشده بود. به هر حال امروزه واکنش خنثی شدن را به این صورت نشان می دهیم:
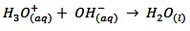
ضعف مدل آرنیوس:
مدل آرینوس یک ایراد مهم دارد. آرنیوس اسید و باز را به محیط آبی محدود کرده بود. حال آن که گاهی یک اسید و یک باز می توانند بدون حضور آب و در فازی غیر محلول، اثر یکدیگر را خنثی کنند.
واکنش آمونیاک با هدروژن کلرید که منجر به تولید نمکی به نام آمونیوم کلرید یا نشادر می شود، بیان گر محدودیت مدل آرنیوس است.
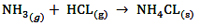
آمونیوم کلرید یا نشادر (NH4CL) یک جامد یونی سفید رنگ است امّا در لحظه ی تشکیل در این واکنش به صورت ریز ذره های معلّق در هوا است که به شکل یک ابر سفید رنگ دیده می شوند. این ذرات بعد از مدتی ته نشین شده و پودر سفید رنگ NH4CL به دست می آید.

سوال: کدام عبارت در ارتباط با مدل آرنیوس نادرست است؟
1- تنها در حالت محلول قابل استفاده است.
2- تعریف محدودی از اسید و باز ارائه می کند.
3- باز آرنیوس ماده ای است که در حلال معین حل می شود و OH(aq)- را تولید یا آزاد می کند.
4- آرنیوس این مدل را با پژوهش روی برقکافت ترکیب های محلول در آب ارائه داد.


 فرمول نویسی فقط در یک صفحه A4
فرمول نویسی فقط در یک صفحه A4  انیمیشن های شیمی (1)
انیمیشن های شیمی (1)