| عنوان | پاسخ | بازدید | توسط |
| |
1 | 123 | alireza663 |
| |
8 | 4992 | mina |
| |
0 | 2426 | alex |
| |
0 | 2804 | alex |
| |
0 | 1290 | hesam |
| |
0 | 1544 | hesam |
| |
0 | 1276 | hesam |
| |
0 | 2337 | hesam |
| |
0 | 1282 | hesam |
| |
0 | 1545 | hesam |
 آهای شیمی اگه جرات داری بیا جلو
آهای شیمی اگه جرات داری بیا جلو
چکیده مطالب شیمی سوم دبیرستان گردآورنده:محمد حسین جان نثار حسینی مدرسه:شهید نصیری مقطع تحصیلی:سوم دبیرستان/تجربی
دانشمندان اسپانیایی نخستین «پلیمر»خود ترمیم شونده را ساخته اند که به طور خود به خودی و مستقل خود را بدون هیچ دخالتی ترمیم می کند. دانشمندان اسپانیایی نخستین پلیمر خود ترمیم شونده را ساخته اند این ماده جدید که پلیمر «نابود گر»نام گرفته است در الهام از روبات نابودگر خواب تغییر شکل دهنده فیلم نابودگر 2 ساخته شده و می تواند امنیت و طول عمر قطعات پلاستیکی همه محصولات از اجزای الکتریکی گرفته تا خودروها و حتی منازل بهبود بخشد . پژوهشگران اسپانیایی می گویند:این نخستین پلیمر خود ترمیم شونده است که می تواند به طور خود به خودی ترمیم های کمی،حتی در غیاب کاتالیزور دست یابد در آزمایش این پلیمر محققان آن را به دو قسمت بریده و سپس تکه ها را به هم فشردند یک نمونه پس از گذشت دو ساعت ۹۷ درصد بهبود ترمیم مشاهده شد و حتی وقتی پلیمر با دست کشیده شد تکه ها از هم جدا نشدند. دانشمندان می گویند:واقعیت این است که پلی مر با ترکیب شیمیایی و خواص مکانیکی مشابه در حال حاضر در طیف گسترده ای از محسولات جاری استفاده شده و این سیستم را برای اجرای سریع و آسان در کاربرد های صنعتی واقعی بسیار جذاب میکند.
به نام خدا
نام محقق : مهدی حبیبی
دبیرستان شهید نصیری
کلاس: 11
« مختصری در باره آرسنیگ »
اطلاعات اولیه
آرسنیک ، عنصر شیمیایی است که در جدول تناوبی با علامت As مشخص است و دارای عدد اتمی ۳۳ میباشد. آرسنیک ، شبه فلز سمی معروفی است که به سه شکل زرد ِ سیاه و خاکستری یافت میشود. آرسنیک و ترکیبات آن ، بعنوان آفتکش مورد استفاده قرار میگیرند: علف کش ، حشره کش و آلیاﮊهای مختلف.

خصوصیات قابل توجه
آرسنیک از نظر شیمیایی شبیه فسفر است، تا حدی که در واکنشهای بیوشیمیایی میتواند جایگزین آن شود. لذا سمی میباشد. وقتی به آن حرارت داده شود، بصورت اکسید آرسنیک در میآید (اکسیده میشود) که بوی آن مانند سیر است. آرسنیک و ترکیبات آن همچنین میتوانند بر اثر حرارت به گاز تبدیل شوند. این عنصر به دو صورت جامد وجود دارد: زرد و خاکستری فلز مانند.
کاربردها
* در قرن بیستم ، آرسنِت سرب بعنوان یک آفت کش برای درختان میوه بهخوبی مورد استفاده قرار گرفت، ( استفاده از آن در افرادِکه به این کار اشتغال داشتند، ایجاد آسیبهای عصب شناسی کرد ) و آرسنیت مس در قرن نوزدهم بعنوان عامل رنگ کننده در شیرینیها بکار رفت.* در سموم کشاورزی و حشره کشهای مختلف استفاده میشود.* آرسنید گالیم یک نیمه رسانای مهمی است که در IC ها بکار میرود. مدارهایی که از این ترکیب ساخته شدهاند، نسبت به نوع سیلیکونی بسیار سریعتر هستند ( البته گرانتر هم میباشند ). آرسنید گالیم بر خلاف سیلیکون آن band gap مستقیم است. پس میتواند در دیودهای لیزری و LED ها برای تبدیل مستقیم الکتریسیته به نور بکار رود.* تریاکسید آرسنیک در خون شناسی برای درمان بیماران سرطان خون حاد که در برابر ATRA درمانی مقاومت نشان میدهند، بکار میرود.* در برنز پوش کردن و ساخت مواد آتش بازی و ترقه مورد استفاده قرار میگیرد.
تاریخچه
آرسنیک ( واﮊه یونانی arsenikon به معنی اریپمنت زرد ) در دوران بسیار کهن شناخته شده است . از این عنصر به کرات برای قتل استفاده شده است. علایم مسمومیت با این عنصر تا قبل از آزمایش مارش تا حدی نا مشخص بود. “آلبرتوس مگنوس” را اولین کسی می دانند که در سال ۱۲۵۰ این عنصر را جدا کرد . “جوان شرودر” در سال ۱۶۴۹ دو روش برای تهیه آرسنیک منتشر کرد.
پیدایش
آرسوپیزیت ( سنگ آرسنیک) که میس پیکل Mispickel هم نامیده میشود، سولفوری است که بر اثر حرارت ، بیشترِن مقدار آرسنیک از سولفید آهن آن جدا میشود. مهمترین ترکیبات آرسنیک عبارت است از: آرسنیک سفید ، سولفید آن ، گرد حشره کش ، آرسنیت کلسیم و آرسنیت سرب.
از گرد حشره کش ، آرسنیت کلسیم و آرسنیت سرب بعنوان سموم و حشره کشها در کشاورزی استفاده میشود .این عنصر گاها” بصورت خالص یافت میشود، ولی معمولا” بصورت ترکیب با نقره ، کبالت ، نیکل ، آهن ، آنتیموان یا سولفور وجود دارد.
هشدارها
آرسنیک و بسیاری از ترکیبات آن سمی هستند. آرسنیک با مختل کردن وسیع سیستم گوارشی و ایجاد شوک ، منجر به مرگ میشود.
خواص فیزیکی و شیمیایی عنصر آرسنیک :
عدد اتمی: 33
جرم اتمی:74.92160
نقطه ذوب : C°808
نقطه جوش : C°603
شعاع اتمی : Å 1.33
ظرفیت: 3و5
رنگ: خاکستری
حالت استاندارد: جامد
نام گروه: 15
انرژی یونیزاسیون : Kj/mol 9.81
شکل الکترونی: 4P 3 2 1s22s2p63s23 p63d 104s
شعاع یونی : Å 0.58
الکترونگاتیوی:2.18
حالت اکسیداسیون: ±3,5
دانسیته: 5.72
گرمای فروپاشی : Kj/mol 369.9
گرمای تبخیر : Kj/mol 34.76
مقاومت الکتریکی : Ohm m 0.00000033
گرمای ویژه: J/g Ko 0.33
دوره تناوبی:4
شماره سطح انرژی : 4
اولین انرژی : 2
دومین انرژی : 8
سومین انرژی : 18
چهارمین انرژی : 5
ایزوتوپ :
ایزوتوپ نیمه عمر
As-71 2.7 روز
As-72 26.0 ساعت
As-73 80.3 روز
As-74 17.8 روز
As-75 پایدار
As-76 26.3 ساعت
As-77 39.0 ساعت
As-79 9.0 دقیقه
اشکال دیگر :
هیدرید ارسنیک AsH3
اکسید ارسنیک As2O3
تری کلرید ارسنیک AsCl3 و پنتا کلرید ارسنیک AsCl5
انواع روشهای موازنه کردن واکنش شیمیایی
واکنشهاي شيميايي را مي توان به صورت معادله هايي نوشت و در آن از نمادهاي شيميايي عنصرها براي نمايش دادن آنها استفاده کرد. بر طبق قانون پايستگي جرم تعداد اتمهاي هر عنصر بايد در دو طرف معادله يکسان باشد يعني معادله بايد موازنه باشد.:.
محلول ها
نام دانش آموز: عادل شيرزاد چناري
دید کلی
محلولها ، مخلوطهایی همگن هستند. محلولها را معمولا بر حسب حالت فیزیکی آنها طبقه بندی میکنند: محلولهای گازی ، محلولهای مایع و محلولهای جامد. بعضی از آلیاژها محلولهای جامدند؛ سکههای نقرهای محلولهایی از مس و نقرهاند و برنج محلولی جامد از روی در مس است. هر آلیاژی محلول جامد نیست، بعضی از آلیاژها مخلوطهایی ناهمگن اند. محلولهای مایع متداولترین محلولها هستند و بیشترین کاربرد را در بررسیهای شیمیایی دارند. هوا هم مثالی برای محلولهای گازی میباشد.
ماهیت محلولها
در یک محلول ، معمولا جزئی که از لحاظ کمیت بیشترین مقدار را دارد، حلال و سایر اجزا را مواد حل شده (حل شونده) میگوییم. اما گاهی آسانتر آن است که جزئی از محلول را با آنکه مقدارش کم است، حلال بنامیم و گاهی اصولا اطلاق نام حلال و حل شونده به اجزای یک محلول (مثلا محلولهای گازی) چندان اهمیتی ندارد. بعضی از مواد به هر نسبت در یکدیگر حل میشوند.
امتزاج پذیری کامل از ویژگیهای اجزای تمام محلولهای گازی و بعضی از اجزای محلولهای مایع و جامد است. ولی غالبا، مقدار ماده ای که در حلال معینی حل می شود، محدود است. انحلال پذیری یک ماده در یک حلال مخصوص و در دمای معین، بیشترین مقداری از آن ماده است که در مقدار معینی از آن حلال حل می شود و یک سیستم پایدار به وجود می آورد.
غلظت محلول
برای یک محلول معین ، مقدار ماده حل شده در واحد حجم حلال یا در واحد حجم محلول را غلظت ماده حل شده میگوییم. مهمترین نوع غلظتها که در آزمایشگاه بکار میرود مولاریته و نرمالیته است. مولاریته عبارت است از تعداد مولهای یک ماده که در یک لیتر محلول وجود دارد. به همین دلیل آن را مول بر لیتر یا M/L میگیرند. نرمالیته یک محلول عبارتست از تعداد هم ارز گرمهای (اکی والان گرم های) ماده موجود در یک لیتر محلول. نرمالیته را با N نشان میدهند.
انواع محلولها
محلولهای رقیق
محلولهایی که غلظت ماده حل شده آنها نسبتا کم است.
محلولهای غلیظ
محلولهایی که غلظت نسبتا زیاد دارند.
محلول سیر شده
اگر مقدار ماده حل شده در یک محلول برابر با انحلال پذیری آن در حلال باشد، آن محلول را محلول سیر شده مینامیم. اگر به مقداری از یک حلال مایع ، مقدار زیادی ماده حل شونده (بیشتر از مقدار انحلال پذیری آن) بیفزاییم، بین ماده حل شده و حل شونده باقیمانده تعادل برقرار میشود. ماده حل شونده باقیمانده ممکن است جامد ، مایع یا گاز باشد. در تعادل چنین سیستمی ، سرعت انحلال ماده حل شونده برابر با سرعت خارج شدن ماده حل شده از محلول است. بنابراین در حالت تعادل ، غلظت ماده حل شده مقداری ثابت است.
محلول سیر نشده
غلظت ماده حل شده در یک محلول سیر نشده کمتر از غلظت آن در یک محلول سیر شده است.
محلول فراسیرشده
میتوان از یک ماده حل شونده جامد ، محلول فراسیر شده تهیه کرد که در آن، غلظت ماده حل شده بیشتر از غلظت آن در محلول سیر شده است. این محلول ، حالتی نیم پایدار دارد و اگر مقدار بسیار کمی از ماده حل شونده خالص بدان افزوده شود، مقداری از ماده حل شده که بیش از مقدار لازم برای سیرشدن محلول در آن وجود دارد، رسوب میکند.
خواص فیزیکی محلولها
بعضی از خواص محلولها به دو عامل ، نوع ماده حل شده و غلظت آن در محلول بستگی دارند. این مطلب برای بسیاری خواص فیزیکی محلولها از جمله ، محلولهای آبی درست به نظر میرسد. برای مثال، محلول نمک طعام در آب بی رنگ پرمنگنات پتاسیم در آب، بنفش صورتی است (در اینجا نوع ماده حل شده مطرح است). افزون بر این ، میدانیم که هر چه بر محلول پرمنگنات آب بریزیم و آن را رقیقتر کنیم، از شدت رنگ آن کاسته میشود (اینجا غلظت محلول مطرح است).
یکی دیگر از خواص فیزیکی که به این دو عامل بستگی دارد، قابلیت هدایت الکتریکی محلول آبی مواد گوناگون است. چهار خاصه فیزیکی دیگر از محلولها وجود دارد که به نوع و ماهیت ذرات حل شده بستگی ندارد، بلکه فقط به مجموع این ذرات وابسته است. به عبارت دیگر ، تنها عامل موثر بر خواص محلول در اینجا ، غلظت است. چنین خواصی از محلول را معمولا "خواص جمعی محلولها" (خواص کولیگاتیو Colligative properties) مینامند و عبارتند از کاهش فشار بخار ، صعود نقطه جوش ، نزول نقطه انجماد و فشار اسمزی.
کاهش فشار بخار
وقتی یک حل شونده غیر فرار در یک حلال حل میشود، فشار بخار آن کاهش مییابد و مقدار کاهش به مقدار حل شونده بستگی دارد. هر چه میزان حل شونده بیشتر باشد، میزان کاهش در فشار بخار بیشتر است. برای مثال اگر دو ظرف را در نظر بگیریم که در آنها مقدار مساوی مایع وجود دارد که یکی محتوی مولکولهای آب خالص و دیگری محتوی محلول قند در آب است، بدیهی است که تعداد مولکولهای آب در واحد حجم از آب قند ، کمتر از آب خالص است. به همین نسبت ، تعداد مولکولهای آب در سطح آب قند ، نیز کمتر میباشد. بنابراین، نسبت مولکولهای پرانرژی آب که قادر به تبخیر از سطح آب قند هستند، کمتر میباشد و در نتیجه فشار بخار محلول کمتر میشود.
افزایش نقطه جوش
در اثر حل شدن مقداری حل شونده غیر فرار در یک حلال ، نقطه جوش آن افزایش مییابد. مقدار افزایش فقط به مقدار حل شونده بستگی دارد. برای مثال ، آب در شرایط متعارفی (دمای 25 درجه سانتیگراد و فشار بخار یک اتمسفر یا 760 میلی متر جیوه) در 100 درجه سانتیگراد می جوشد. اما اگر در آب، مقداری قند مثلا به غلظت یک مولال (یک مول در 1000 گرم آب) بریزیم، فشار بخار محلول آب قند به اندازه 14 میلی متر جیوه کاهش مییابد و در نتیجه محلول در 52/100درجه سانتیگراد میجوشد.
کاهش نقطه انجماد
وقتی یک حل شونده غیر فرار در یک حلال حل میشود، نقطه انجماد آن کاهش مییابد. بنابراین دمای انجماد محلولهای آبی همیشه کمتر از دمای انجماد آب خالص است. استفاده از این خاصیت در رادیاتور اتومبیل میباشد که برای جلوگیری از یخ زدن آب رادیاتور اتومبیل در زمستان ، به آن مقداری مایع به نام ضد یخ میافزایند. همچنین با اضافه کردن نمک (مانند کلرید سدیم) همراه با شن ریز روی آسفالت خیابانهای شهر ، هیدراته شدن یونهای نمکها مستلزم مصرف مقداری آب است که از ذوب شدن برف فراهم می گردد. بنابراین آب نمک غلیظی فراهم میشود که حتی در 20 درجه زیر صفر منجمد نمیشود.
فشار اسمزی
اگر در ظرف U شکلی ، حلال A از مخلوط حلال و حل شونده (B + A) به وسیله یک غشای نیمه تراوا ، جدا شود، چون فقط حلال از غشا عبور میکند، بعد از رسیدن به حالت تعادل ، ارتفاع مایع در قسمت (حاوی B + A) که حل شونده وجود دارد بالا می رود.
اگر به این ستون فشار وارد شود تا سطح مایع در دو طرف یکسان شود، این فشاراسمزی است که به علت حل شدن حل شونده غیر فرار در حلال ایجاد شده است.
به عکس فرآیند اسمز ، اسمز معکوس گویند که برای شیرین کردن آب استفاده می شود. همچنین برای تعیین جرم مولکولی پلیمرها ، پروتئینها و بطور کلی مولکولهای سنگین از فشار اسمزی استفاده میشود.
کیسه هوا
در ایربگ، 3 قسمت وجود دارد که در مجموع باعث انجام کار مذکور می شود:
1- کیسه نازکی از پارچه نایلونی که در فرمان و داشبورد و این اواخر در درها و صندلیها تا شده و جاسازی می شود.
2- سنسور تصادف که باعث inflateیا همان بادشدن و فعال شدن کیسه هوا می شود. فعال شدن کیسه هوا وقتی اتفاق می افتد که نیروی تصادف، حداقل، معادل نیرویی باشد که در اثر برخورد با یک دیوار آجری با سرعت 10تا 15 مایل بر ساعت(16 تا 24 کیلومتر بر ساعت) ایجاد می شود.این سنسور اطلاعات موردنیاز را از یک شتاب سنج که در یک تراشه جاسازی شده دریافت می کند.

| استوکیومتری ( برگرفته تاز واژه های یونانی Stoichein به معنی عنصر و metron به معنی اندازه گیری ) شاخه ای از علم شیمی است که با روابط کمی میان عناصر در تشکیل مواد مرکب و میان عناصر و مواد مرکب درواکنشهای شیمیایی سروکار دارد. استوکیومتری یک ماده مرکب بر فرمول شیمیایی آن ماده مرکب استوار است. |
اثرات زیست محیطی مصرف کودهای شیمیایی
(خاك سالم- گياه سالم- انسان سالم)
اثرات زیست محیطی مصرف کودهای شیمیایی
راه درمان: کشاورزی اورگانیک (Organic agriculture)
![]() تا اواخر دهه هفتاد میلادی افزایش مصرف کود شیمیایی موثرترین و ارزان ترین روش تامین مواد غذایی مورد نیاز مردم در تمامی جهان به ویژه در کشورهای در حال توسعه محسوب می شد. به تدریج از اوایل دهه ی 80 میلادی به بعد اثرات سوء مصرف کنترل نشده کودهای شیمیایی بر طبیعت به ویژه در کشورهای پیشرفته که در ابعاد گسترده تری کودهای شیمیایی را تولید و مصرف می نمودند ظاهر گردید. گستردگی مصرف انواع کودهای شیمیا یی اثرات نامطلوبی در تمامی سطح زیر کشت بر جای گذاشته و کودهای شیمیایی به عنوان عامل اصلی آلوده کننده محیط زیست در بسیاری از مناطق جهان شناخته می شوند.
تا اواخر دهه هفتاد میلادی افزایش مصرف کود شیمیایی موثرترین و ارزان ترین روش تامین مواد غذایی مورد نیاز مردم در تمامی جهان به ویژه در کشورهای در حال توسعه محسوب می شد. به تدریج از اوایل دهه ی 80 میلادی به بعد اثرات سوء مصرف کنترل نشده کودهای شیمیایی بر طبیعت به ویژه در کشورهای پیشرفته که در ابعاد گسترده تری کودهای شیمیایی را تولید و مصرف می نمودند ظاهر گردید. گستردگی مصرف انواع کودهای شیمیا یی اثرات نامطلوبی در تمامی سطح زیر کشت بر جای گذاشته و کودهای شیمیایی به عنوان عامل اصلی آلوده کننده محیط زیست در بسیاری از مناطق جهان شناخته می شوند.
قانون آووگادرو
عدد آووگادرو عددی نیست که شما روزانه روی در و دیوار خیابان ببینید. شما این عدد را فقط در کتب درسی شیمی مشاهده خواهید کرد که مقدار آن 6.0221415 × 1023 هست که میتوان آن را به شکل 602,214,150,000,000,000,000,000 نیز نوشت. برای صرفه جویی در وقت این عدد را میتوانید "یک مول" بخوانید.
همانطور که یک جین مقدار 6 عدد از یک چیز است، یک مول نیز به سادگی مقدار عدد آووگادرو از یک چیز است که این یک چیز اتم یا مولکول است. در نظریه، شما میتوانید یک مول توپ بیسبال داشته باشید که میتواند کل سطح زمین را به ارتفاع چند صد مایل بپوشاند! شما خیلی باید تلاش کنید تا ذرهای مناسب تر و بزرگتر از مولکول به مقدار یک مول پیدا کنید. بنابراین اگر مول فقط برای شیمی مورد استفاده قرار میگیرد، چگونه آمدئو آووگادرو (نام کامل: لورنزو رومانو آمدئو کارلو آووگادرو، Lorenzo Romano Amedeo Carlo Avogadro) و علم شیمی با هم ارتباط برقرار کردند؟
او در سال 1776 در ایتالیا متولد شد، آووگادرو در زمان دورهی مهمی از توسعه علم شیمی بزرگ شد. شیمیدانانی نظیر جان دالتون (John Dalton) و جوزف لوییس گیلوساک (Joseph Louis Gay-Lussac) فهم خواص ابتدایی اتمها و مولکولها را شروع کرده بودند، و بشدت با هم در حال منازعه بودند که چگونه این ذرات کوچک بطور لایتجزاء رفتار میکنند. قانون مقادیر اختلاط (law of combining volumes) گیلوساک بصورت ویژه آووگادرو را علاقهمند کرد. این قانون بیان میکرد که زمانیکه دو مقدار گاز با یکدیگر واکنش میدهند تا یک گاز سومی را بسازند، درصد میان مقدار واکنش دهندهها و مقدار محصول همیشه از اعداد صحیح ساده میباشد. یک مثال ساده در این زمینه: دو مقدار از گاز هیدروژن با یک مقدار از گاز اکسیژن مخلوط میشود تا دو مقدار از بخار آب را تشکیل دهد (حداقل زمانیکه دما به اندازه کافی بالا است) بدون هیچ باقیماندهای، یا:
2H2 + O2 --> 2H2O
با سرهم بندی مفاهیم این قانون، آووگادرو نتیجه گرفت که در اصل باید مقادیر مساوی از هر دو گازی در دما و فشار ثابت باید از مقادیر مساوی از ذرات تشکیل شده باشند (قانون آووگادرو). و تنها راه برای توضیح درستی این قانون برای هر مثالی، که شامل مثال اخیر ما نیز میشود، این هست که باید اختلافی بین اتم عناصر و مولکول همان عناصر وجود میداشت، مانند اکسیژن، که در واقع به عنوان مولکولی وجود دارد نه بصورت تک اتمی (یعنی O¬2 نه اتم O تک). آووگادرو کلماتی مانند "مولکول" را برای توصیف نظریهی خود در اختیار نداشت، و ایدههایش در میان بقیه دانشمندان با مخالفت جان دالتون مواجه میشد. این باعث شد تا یک شیمیدان دیگر به نام استنیسلائو کنیزارو (Stanislao Cannizaro) توجه ویژهای که لیاقت نظریات آووگادرو را داشت جلب این نظریات کند. زمانیکه این نظریات مورد توجه قرار گرفتند، آن شخص ایتالیایی با نام بلند خود که دیوانه انگاشته میشد، مرده بود.
|
|
| قانون آووگادرو |
 |
| ژان باپتیست پرن |
بنابراین چگونه عدد آووگادرو به این نام شناخته میشود؟ به دلیل اینکه قانون آووگادرو یک اقدام بسیار مهم در پیشرفت شیمی بود، شیمیدان ژان باپتیست پرن (Jean Baptiste Perrin) به افتخار او نام این عدد را نام او گذاشت. با خواند ادامه مطلب خواهید دریافت که چگونه دانشمندان عدد آووگادرو را تخمین زدند، عددی که حتی امروزه هم یکی از بخشها بسیار مهم علم شیمی است.
عدد آووگادرو در عمل
چگونه روی کره خاکی دانشمندان روی چنین عددی که به نظر میرسد اختیاری باشد با هم به توافق رسیدند؟ برای فهم چگونگی رسیدن به این نتیجه، ما باید ابتدا مفهوم واحد جرم اتمی (amu) را درک کنیم. واحد جرم اتمی بعنوان 12/1 جرم یک اتم کربن-12 (معمولترین ایزوتوپ کربن) تعریف شده است. و اما چرا این اتم انتخاب شده است: کربن-12 دارای 6 پروتون، 6 نوترون و 6 الکترون است و به این دلیل که الکترونها جرم بسیار کمی دارند، 12/1 جرم یک اتم کربن-12 بسیار نزدیک به جرم یک پروتون یا نوترون تک است. وزنهای اتمی عناصر (اعدادی که شما در زیر عناصر در جدول تناوبی میبینید) با مفهوم واحد جرم اتمی بیان شدهاند. برای مثال، هیدروژن بطور متوسط دارای جرم اتمی 1.00794 amu میباشد.
متاسفانه، شیمیدانها دارای مقیاسی نبودند که بتواند واحدهای جرم اتمی را اندازهگیری کند، و آنها قطعا توانایی این را نداشتند که یک اتم تک را زمانیکه یک واکنش در حال انجام است، اندازهگیری کنند. به این دلیل که اتمهای مختلف مقادیر جرم متفاوت دارند، شیمیدانها باید راهی پیدا میکردند که شکاف میان دنیای نامرئی اتمها و مولکولها و دنیای ذرات شیمی آزمایشگاهی که توسط مقیاسها و اندازهگیریها بر حسب گرم بود را پر کنند. در حقیقت برای انجام این کار، آنها یک رابطه میان واحد جرم اتمی و گرم ایجاد کردند، و این رابطه به شکل زیر بود.
1 amu = 1/6.0221415 x 1023 grams
این رابطه به این معنا است که اگر ما مقدار عدد آووگادرو یا یک مول از اتمهای کربن-12 داشته باشیم (که طبق تعریف دارای وزن اتمی 12 amu هست)، این نمونه از کربن-12 دارای دقیقا وزن 12 گرم است. شیمیدانها از این رابطه استفاده کردند تا به راحتی واحد قابل اندازهگیری گرم و واحد نامرئی مول اتم و مولکول را به یکدیگر تبدیل کنند.
 |
| رابرت میلیکان |
حالا که میدانیم چگونه عدد آووگادرو مورد استفاده قرار گرفت، باید به آخرین سوال پاسخ دهیم: در درجه اول چگونه دانشمندان تخمین زدند که چند اتم در یک مول وجود دارد؟ اولین تخمین دشوار از رابرت میلیکان (Robert Millikan) بود، کسی که مقدار بار یک الکترون را اندازهگیری کرده بود. بار یک مول از الکترونها، یک فارادی خوانده میشود، که در زمان میلیکان شناخته شده بود تا بتواند اکتشاف خود را انجام دهد.
تقسیم یک فارادی بر حسب بار یک الکترون به ما عدد آووگادرو را میدهد. در طول زمان، دانشمندان راههای جدیدتر و دقیقتری برای تخمین عدد آووگادرو بدست آوردند، که از همه جدیدتر استفاده از تکنیکهای پیشرفتهای نظیر استفاده از اشعه X برای آزمایش کردن هندسه یک کیلوگرم گوی از سیلیکون و تخمین تعداد اتمهایی که دارا است از روی دادهها است. و زمانیکه کیلوگرم پایهی تمامی واحدهای جرمی است، بعضی از دانشمندان در عوض شروع به استفاده از عدد آووگادرو کردند، که بیشتر شبیه این است که امروزه ما طول یک متر را بر حسب سرعت نور تعریف کنیم به جای راههای دیگری که معمولتر هستند.
تهیه شده توسط عرفان ناطقی-کلاس 011-شهید نصیری-1392/09/25
درصد خلوص مواد
در آزمایشگاه شیمی و روی بطری هایی که مواد مختلف در آنها نگهداری می شود، معمولاً درصد خلوص آن ماده نوشته می شود. زیرا به طور کلی موادی که از آن ها در آزمایشگاه یا صنعت از آن استفاده می کنیم خالص نیستند.
اگر روی ظرف نگهداری کلرید سدیم عدد 8/99 % نوشته شده باشد؛ بدین معناست که اگر 100 گرم از این ماده داشته باشیم 8/99 گرم آن کلرید سدیم و 2/0 گرم ناخالصی دارد.
در بسیاری از آزمایش هایی که در صنعت یا در آزمایشگاه انجام می شود، معمولاً برای تهیه مقدار معینی از یک ماده ی خالص، همواره باید مقدار بیشتری از ماده ی خالص واکنش دهنده ی را در نظر بگیریم. درصد خلوص یک ماده مقدار گرم ماده ی خالص درصد خالص درصد گرم ماده ی ناخالص را نشان می دهد. که به صورت زیر محاسبه می شود:
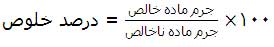
برای حل مسائل درصد خلوص، معمولاً سه حالت زیر پیش می آید:

حالت اول: در این حالت هم جرم ماده ی ناخالص و هم درصد خلوص آن مشخص باشد. در این صورت کافی است جرم ماده ی ناخالص را در درصد خلوص به صورت(a/100) ضرب کنیم.
مثال) مقدار 7 گرم کلرات پتانسیم که دارای خلوص 70% است، تجزیه می کنیم، در این حالت چند مول اکسیژن تولید می شود؟
پاسخ: ابتدا معادله ی تجزیه کلرات پتانسیم را نوشته و معادله ی آن را موازنه می کنیم.
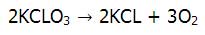
از اطلاعات ارائه شده می دانیم که مقدار KCLO3، هفت گرم می باشد با درصد خلوص 70% و می بایستی مقدار مول تولید شده ی اکسیژن را بیابیم.
به طور کلی مقدار کلرات پتانسیم شرکت کننده در واکنش a از طریق زیر محاسبه می شود.
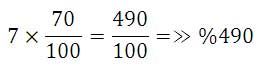
با توجه به جدول تناوبی، جرم مولی مواد تشکیل دهنده ی کلرات پتاسیم، جرم مولی کلرات پتانسیم را می یابیم.
O=16g/mol Cl=35/5g/mol K=39g/mol
g/mol 5/122=16×3+35+ 39= جرم کلرات پتانسیم
با توجه به معادله ی واکنش تجزیه ی کلرات پتانسیم متوجه می شویم که بازای 2 مول از کلرات پتانسیم، 3 مول اکسیژن به دست می آید؛

پس بازای تجزیه 7 گرم کلرات پتانسیم 70 % ، 06/0 مول اکسیژن آزاد می شود.
حالت دوم: در برخی از مسائل ممکن است درصد خلوص ماده ای داده شده باشد و جرم آن مطلوب مسئله باشد. در این صورت می بایستی بعد از حل مسئله؛ درصد خلوص را به صورت 100/a در جرم مولی ضرب شود.
حالت سوم: حالتی است که در آن مسائل، جرم ماده ی ناخالص معلوم باشد ولی درصد خلوص آن مورد سؤال باشد. در این صورت می بایستی روابط استوکیومتری جرم ماده خالص را محاسبه کرده و سپس با توجه به رابطه ی زیر، درصد خلوص ماده را می یابیم.
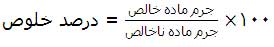
روابط مولي – مولي در محاسبه هاي استوكيومتري
استوكيومتري فرمولي: مي دانيد كه فرمول شيميايي هر تركيب نشان دهنده ي نوع و تعداد اتمهاي تشكيل دهنده ي آن است.براي مثال فرمول شيميايي كربن دي اكسيد
![[تصویر: 21678.jpeg]](http://www.chemistmag.com/forum/images/post_images/21678.jpeg) نشان مي دهد كه هر مولكول
نشان مي دهد كه هر مولكول ![[تصویر: 21678.jpeg]](http://www.chemistmag.com/forum/images/post_images/21678.jpeg) از يك اتم كربن و دو اتم اكسيژن تشكيل شده است به همين ترتيب هر مول
از يك اتم كربن و دو اتم اكسيژن تشكيل شده است به همين ترتيب هر مول ![[تصویر: 115724.jpeg]](http://www.chemistmag.com/forum/images/post_images/115724.jpeg) يك مول اتم كربن و دومول اتم اكسيژن دارد و مي توان نسبت تعداد اتم هاي (يا مول هاي) كربن به اكسيژن را به صورت زير نمايش داد:
يك مول اتم كربن و دومول اتم اكسيژن دارد و مي توان نسبت تعداد اتم هاي (يا مول هاي) كربن به اكسيژن را به صورت زير نمايش داد:![[تصویر: 21681.jpeg]](http://www.chemistmag.com/forum/images/post_images/21681.jpeg)
![[تصویر: 21762.jpeg]](http://www.chemistmag.com/forum/images/post_images/21762.jpeg)
پاور پوینت تاثیرات نابودی اوزون بر زمین
اوزون یک فرم سه اتمی می باشد که در جو بالای زمین مو جود است . لایه اوزون واقع در استراتوسفر و حدود 15 تا 30 کیلومتر بالاتر از سطح زمین است . . .
دانلود در ادامه مطلب . . .
**فصل۱ **
معادله نوشتاری: معادله واکنش که تنها شامل نام واکنش دهنده ها درسمت چپ و نام فرآورده ها درسمت راست می باشد.
معادله نمادی: معادله کامل واکنش که در آن از نمادها و فرمول های شیمیایی مواد واکنش دهنده و فرآورده استفاده می کنیم و حالت فیزیکی آن ها و شرایط انجام واکنش نیز ذکر می شود.
واکنش سوختن: واکنشی که در آن واکنش دهنده با سرعت و شدت با اکسیژن ترکیب می شود و فرآورده اکسیژن دار به همراه انرژی آزاد شده بشکل نور و گرما، به دست می آید. مثل سوختن هیدروکربن ها وسوختن فلز منیزیم.
واکنش اکسایش: واکنشی که در آن واکنش دهنده با سرعت کم با اکسیژن واکنش می دهند مثل زنگ زدن آهن در هوای مرطوب یا اکسایش تدریجی نوار منیزیم با گذشت زمان.
ساختن موشك با استفاده از هیدروژن پری اكسید و نقره
برای این كار هیدروژن پری اكسید باید غلیظ شده باشد.(در حدود 90 درصد ) هیدروژن پری اكسید كه در دارو خانه ها میفروشند غلظلتش درحدود 3 در صد است.فرمول شیمیایی هیدروژن پری اكسید H2O2 است.وقتی با نقره واكنش برقرار میكند نقره نقش كاتالیزور را بازی میكند.این واكنش اتم اضافه اكسیژن را ازاد كرده اب و گرمای زیادی تولید میكند.
شکلگیری الماس.jpg)
برای تشکیل هرسنگ نیاز به شرایط خاصی است که این شرایط برای تشکیل الماس نیز مشخص است و از آنجایی که شرایط تشکیل الماس، فشار بسیار بالایی را نیاز دارد بنابراین امکان تشکیل الماس در اعماق ۱۴۰الی ۱۹۰ کیلومتر درون زمین میسر است و بهطورکلی الماس در دومحیط متفاوت تشکیل میشود...
داریوش سلامی ..................................................................................... کارشناسی ارشد شیمی فیزیک................................................................... دبیرشیمی ناحیه1رشت .......................................................................... .shimisalami@yahoo.com ................................................................ شیمی یکی از مهمترین علوم پایه است که نقش کلیدی در زندگی بشر امروزی دارد و هر جنبه از زندگی ما ارتباط نزدیکی با این علم دارد.



 1xbet is a scam site
1xbet is a scam site شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی
شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی