به نام خدا
نام و نام خانوادگی:دانیال آدربین
نام دبیر:آقای سلامی
نام مدرسه:ملاصدرا1
نام کلاس:06
فیبر نوری چیست و چگونه کار میکند؟
هرجا که صحبت از سیستم های جدید مخابراتی، سیستم های تلویزیون کابلی و اینترنت باشد، در مورد فیبر نوری هم چیزهایی میشنوید.
فیبرنوری چیست؟
فیبرهای نوری رشته های بلند و نازکی از شیشه بسیار خالصند که ضخامتی در حدود قطر موی انسان دارند. آنها در بسته هایی بنام کابلهای نوری کنار هم قرار داده میشوند و برای انتقال سیگنالهای نوری در فواصل دور مورد استفاده قرار میگیرند. از آنها همچنین برای عکسبرداری پزشکی و معاینه های فنی در مهندسی مکانیک استفاده میشود.
اگر با دقت به یک رشته فیبر نوری نگاه کنید، می بینید که از قسمتهای زیر ساخته شده :
• هسته _ هسته بخش مرکزی فیبر است که از شیشه ساخته شده و نور در این قسمت سیر میکند.
• لایه روکش _ واسطه شفافی که هسته مرکزی فیبر نوری را احاطه میکند وباعث انعکاس نور به داخل هسته میشود.
• روکش محافظ _ روکشی پلاستیکی که فیبر نوری در برابر رطوبت و آسیب دیدن محافظت میکند.
صدها یا هزاران عدد از این رشته های فیبر نوری بصورت بسته ای در کنار هم قرار داده میشوند که به آن کابل نوری گویند. این دسته از رشته های فیبر نوری با یک پوشش خارجی موسوم به ژاکت یا غلاف محافظت میشوند.
فیبرهای نوری دو نوعند :
1. فیبرهای نوری تک وجهی: این نوع از فیبرها، هسته های کوچکی دارند ( قطری در حدود inch (4-) 10x 5/3 یا 9 میکرون ) و میتوانند نور لیزر مادون قرمز ( با طول موج 1300 تا 1550 نانومتر ) را درون خود هدایت کنند.
2. فیبرهای نوری چند وجهی: این نوع از فیبرها هسته های بزرگتری دارند ( قطری در حدود inch (3-) 10x 5/2 یا 5/62 میکرون ) و نور مادون قرمز گسیل شده از دیودهای نوری موسوم به LED ها را ( با طول موج 850 تا 1300 نانومتر ) درون خود هدایت میکنند.
برخی از فیبرهای نوری از پلاستیک ساخته میشوند. این فیبرها هسته بزرگی ( با قطر 4 صدم inch یا یک میلیمتر ) دارند و نور مرئی قرمزی را که از LED ها گسیل میشود ( و طول موجی برابر با 650 نانومتر دارد ) هدایت میکنند.
بیایید ببینیم طرز کار فیبر نوری چیست.
یک فیبر نوری چگونه نور را هدایت میکند؟
فرض کنید میخواهید یک باریکه نور را بطور مستقیم و در امتداد یک کریدور بتابانید. نور براحتی در خطوط راست سیر میکند و مشکلی ازین جهت نیست. حال اگر کریدور مستقیم نباشد و در طول خود خمیدگی داشته باشد چگونه نور را به انتهای آن میرسانید؟
برای این منظور میتوانید از یک آینه استفاده کنید که در محل خمیدگی راهرو قرار میگیرد و نور را در جهت مناسب منحرف میکند. اگر راهرو خیلی پیچ در پیچ باشد و خمهای زیادی داشته باشد چه؟ میتوانید دیوارها را با آینه بپوشانید و نور را به دام بیندازید بطوریکه در طول راهرو از یک گوشه به گوشه دیگر بپرد. این دقیقا همان چیزی است که در یک فیبرنوری اتفاق می افتد.
نور در یک کابل فیبرنوری، بر اساس قاعده ای موسوم به بازتابش داخلی، مرتبا بوسیله دیواره آینه پوش لایه ای که هسته را فراگرفته، به این سو و آن سو پرش میکند و در طول هسته پیش میرود.
از آنجا که لایه آینه پوش اطراف هسته هیچ نوری را جذب نمیکند، موج نور میتواند فواصل طولانی را طی کند. به هر حال، برخی از سیگنالهای نوری در حین حرکت در طول فیبر، ضعیف میشوند که علت عمده آن وجود برخی ناخالصیها داخل شیشه است. میزان ضعیف شدن سیگنال به درجه خلوص شیشه بکار رفته در داخل فیبر و نیز طول موج نوری که درون فیبر سیر میکند بستگی دارد.
سیستم ارتباط بوسیله فیبرنوری
برای پی بردن به اینکه فیبرهای نوری چگونه در سیستم های ارتباطی مورد استفاده قرار میگیرند، اجازه دهید نگاهی بیاندازیم به فیلم یا سندی که مربوط به جنگ جهانی دوم است. دو کشتی نیروی دریایی را درنظر بگیرید که از کنار یکدیگر عبور میکنند و لازم است باهم ارتباط برقرار کنند درحالی که امکان استفاده از رادیو وجود ندارد و یا دریا طوفانی است. کاپیتان یکی از کشتی ها پیامی را برای یک ملوان که روی عرشه است میفرستد. ملوان آن پیام را به کد مورس ترجمه میکند و از نورافکنی ویژه که یک پنجره کرکره جلو آن است برای ارسال پیام به کشتی مقابل استفاده مینماید. ملوانی که در کشتی مقابل است این پیام مورس را میگیرد، ترجمه میکند و به کاپیتان میدهد. (ملوان کشتی دوم عکس عملی را انجام میدهد که ملوان کشتی اول انجام داد.)
حالا فرض کنید این دو کشتی هر یک در گوشه ای از اقیانوسند و هزاران مایل فاصله دارند و در فاصله بین آنها یک سیستم ارتباطی فیبرنوری وجود دارد.
سیستمهای ارتباط بوسیله فیبرنوری، شامل این قسمت هاست:
• فرستنده: سیگنالهای نور را تولید میکند و به رمز در میآورد.
• فیبرنوری: سیگنالهای نور را تا فواصل دور هدایت میکند.
• تقویت کننده نوری: ممکن است برای تقویت سیگنالهای نوری لازم باشد. (برای ارسال سیگنال به فواصل خیلی دور)
• گیرنده نوری: سیگنالهای نور را دریافت و رمزگشائی مینماید.
فرستنده
نقش فرستنده شبیه ملوانی است که روی عرشه کشتی فرستنده پیام ایستاده و پیام را ارسال میکند. فرستنده ابزار تولید نور را در فواصل زمانی مناسب خاموش یا روشن میکند.
فرستنده درعمل به فیبر نوری متصل میشود و حتی ممکن است دارای لنزی برای متمرکز کردن نور به داخل فیبر هم باشد. قدرت اشعه لیزر بیش از LED هاست اما با کم و زیاد شدن دما شدت نورشان تغییر میکند و گرانتر هم هستند. متداولترین طول موجهایی که استفاده میشود عبارتند از: 850 نانومتر، 1300 نانومتر و 1550 نانومتر. (مادون قرمز و طول موجهای نامرئی طیف).
تقویت کننده نوری
همانطور که قبلا هم به آن اشاره شد، نور حین عبور از فیبر ضعیف میشود. (مخصوصا در فواصل طولانی بیش از نیم مایل یا حدود یک کیلومتر مثلا در کابلهای زیر دریا) بنابرین یک یا بیش از یک تقویت کننده نوری در طول کابل بسته میشوند تا نور ضعیف شده را تقویت کنند.
یک تقویت کننده نوری دارای فیبرهای نوری با پوشش ویژه ای است. نور ضعیف شده پس از ورود به این تقویت کننده تحت تاثیر این پوشش خاص و نیز نور لیزری که به این پوشش تابیده میشود تقویت میشود. ملکولهای موجود در این پوشش ویژه با تابش لیزر به آنها، سیگنال نوری جدید و قوی تولید میکنند که مشخصات آن مشابه نور ورودی به تقویت کننده است. درواقع تقویت کننده نوری یک آمپلی فایر لیزری برای نور ورودی به آن است.
گیرنده نوری
گیرنده نوری مشابه ملوانی که روی عرشه کشتی گیرنده پیام بود عمل میکند. این گیرنده سیگنالهای نوری ورودی را میگیرد، رمزگشائی میکند و سیگنالهای الکتریکی مناسب را برای ارسال به کامپیوتر، تلویزیون یا تلفن کاربر تولید و به آنها ارسال می نماید. این گیرنده برای دریافت و آشکارسازی نور ورودی از فتوسل یا فتودیود استفاده میکند.
منبع: persianit.ir


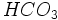 ) در آب خالص است.
) در آب خالص است.

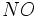
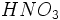


 1xbet is a scam site
1xbet is a scam site شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی
شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی تغییرات دمایی: علی حسن زاده
تغییرات دمایی: علی حسن زاده