| عنوان | پاسخ | بازدید | توسط |
| |
1 | 123 | alireza663 |
| |
8 | 4992 | mina |
| |
0 | 2426 | alex |
| |
0 | 2803 | alex |
| |
0 | 1289 | hesam |
| |
0 | 1543 | hesam |
| |
0 | 1276 | hesam |
| |
0 | 2337 | hesam |
| |
0 | 1281 | hesam |
| |
0 | 1545 | hesam |
کاری از آرمین بهروج
اروین شرودینگر پس از محاسبه های فراوان به این نتیجه رسید که برای مشخص کردن هر اوربیتال اتم مانند جسم در فضا به سه عدد مانند طول ،عرض،ارتفاع نیاز است که شرودینگر از عددهای کوانتومی n،l،ml استفاده کرد.
تعریف اعداد کوانتومی در ادامه مطلب
به نام خدا
کتابهای متعددی این سوالات را گردآوری کرده اند که موفقترین آنها دوره دو جلدی "شیمی در سپهر المپیاد" نوشته مرتضی خلینا میباشد. از نکات بارز این کتاب، ترجمه روان و طبقه بندی مناسب سوالات چند گزینه ای به همراه پاسخ تشریحی برای تمام آنها است.
سایت المپیادهای علمی ایران تصمیم گرفته است تا تمام سوالات این مجموعه از سال 1987 تا سال 2006 را به همراه پاسخ کلیدی در اختیار دانش آموزان ایرانی قرار دهد.
 دانلود سوالات المپیاد شیمی آمریکا، کانادا و استرالیا / فصل اول / ساختار اتم
دانلود سوالات المپیاد شیمی آمریکا، کانادا و استرالیا / فصل اول / ساختار اتم دانلود سوالات المپیاد شیمی آمریکا، کانادا و استرالیا / فصل دوم / خواص تناوبی
دانلود سوالات المپیاد شیمی آمریکا، کانادا و استرالیا / فصل دوم / خواص تناوبی دانلود سوالات المپیاد شیمی آمریکا، کانادا و استرالیا / فصل سوم / پیوندهای یونی
دانلود سوالات المپیاد شیمی آمریکا، کانادا و استرالیا / فصل سوم / پیوندهای یونی دانلود سوالات المپیاد شیمی آمریکا، کانادا و استرالیا / فصل چهارم / پیوندهای کووالانسی
دانلود سوالات المپیاد شیمی آمریکا، کانادا و استرالیا / فصل چهارم / پیوندهای کووالانسی دانلود سوالات المپیاد شیمی آمریکا، کانادا و استرالیا / فصل پنجم / کربن و ترکیبهای آلی
دانلود سوالات المپیاد شیمی آمریکا، کانادا و استرالیا / فصل پنجم / کربن و ترکیبهای آلیمنبع : المپیادهای علمی ایران آیریسک
نمايي از عنصر Hs
(از واژه لاتین هاسیاس به معنای هس گرفته شده که ایالتی در آلمان است) هسیم در سال 1984، توسط پیتر آرمبروستر، گوتفراید مونزنبر و همکارانش در GSI دارمستارت آلمان کشف شد.
عنصر Hs در طبيعت
اثرات هسیم بر روی سلامتی
هسیم آن قدر ناپایدار است که هر مقداری از آن تشکیل شود، به سرعت به عناصر دیگر تبدیل می شود. بنابراین لزومی ندارد که اثرات و خطرات آن را بر روی سلامتی بررسی کنیم.
اثرات زیست محیطی هسیم
به علت نیمه عمر بسیارکوتاه هسیم (حدود 12 دقیقه)، لزومی ندارد که اثرات آن را بر روی محیط زیست بررسی کنیم.
خواص فیزیکی و شیمیایی عنصر هسیم :
عدد اتمی:108
جرم اتمی:265
حالت استاندارد: جامد
رنگ: خاکستری
نام گروه:اکتنید8
دوره تناوبی :7
شکل الکترونی: Rn7s25f146d 6
شماره سطح انرژی : 7
اولین انرژی : 2
دومین انرژی : 8
سومین انرژی : 18
چهارمین انرژی : 32
پنجمین انرژی : 32
ششمین انرژی : 14
هفتمین انرژی : 2
ایزوتوپ :
ایزوتوپ نیمه عمر
Hs-265 2.0 میلی ثانیه نمايي از عنصر Mt
در 29 آگوست 1982، فیزیکدانان آزمایشگاه تحقیقاتی هوی یون در دارمستات آلمان غربی با بمباران209Bi با هسته های شتاب گرفته 58Fe ، عنصر 109 را شناسایی کرده و ساختند. اگر انرژی ترکیبی دو هسته بالا باشد، نیروهای دافعه میان هسته ها بر آن غلبه خواهد کرد.
در این آزمایش برای تولید یک هسته منفرد، باید هدف یک هفته بمباران می شد. این گروه وجود عنصر 109 را با چهار اندازه گیری مستقل، تصدیق کردند. اتم تازه تشکیل شده با سرعت پیش بینی شده، از هدف برگشت و با ***** سرعتی که جدیدا توسعه یافته بود، از هسته های کوچکتر و سریعتر جدا شد. زمان حرکت به سمت آشکارساز و انرژی اندازه گیری شد و با مقادیر پیش بینی شده منطبق بود.
هسته های 266X، ظرف 5 ثانیه بعد از برخورد به آشکارساز شروع به تجزیه کردند. ذرات آلفای پر انرژی ساطع شده و 267/107X را تولید کردند. در عوض ذرات آلفای از خود ساطع کرده و به 258/104Rf تبدیل شد و این عنصر به هسته های دیگر نبدیل شد. این آزمایش نشان داد که استفاده از روشهای شکافت مانند روش ساخت هسته های جدید و سنگین، ساده است.
عنصر Mt در طبيعت
اثرات میتریم بر روی سلامتی
میتریم آن قدر ناپایدار است که هر مقداری از آن تشکیل شود، به سرعت به عناصر دیگر تبدیل می شود. بنابراین لزومی ندارد که اثرات و خطرات آن را بر روی سلامتی بررسی کنیم.
اثرات زیست محیطی میتریم
به علت نیمه عمر بسیارکوتاه میتریم (حدود 3.8 میلی ثانیه)، لزومی ندارد که اثرات آن را بر روی محیط زیست بررسی کنیم.
خواص فیزیکی و شیمیایی عنصر میتریم :
عدد اتمی:109
جرم اتمی:265
حالت استاندارد: نامشخص احتمالاً جامد
رنگ: خاکستری
نام گروه:اکتنید 9
دوره تناوبی :7
شکل الکترونیRn7s25f146d7
شماره سطح انرژی : 7
اولین انرژی : 2
دومین انرژی : 8
سومین انرژی : 18
چهارمین انرژی : 32
پنجمین انرژی : 32
ششمین انرژی : 15
هفتمین انرژی : 2
ایزوتوپ :
ایزوتوپ نیمه عمر
Mt-226 3.4 میلی ثانیه
فرانسیم
فرانسیُم (به فرانسوی: Francium) با نام قدیمی اکا-سزیم و یا اکتینیم K، عنصری شیمیایی با نماد Fr و عدد اتمی ۸۷ است که در گروه IA (فلزهای قلیایی) و دورهٔ هفتم قرار گرفتهاست. این عنصر، یک الکترون ظرفیتی دارد و در میان همهٔ عناصر جدول تناوبی، دارای کمترین الکترونگاتیوی است.
دمای ذوب و جوش فرانسیم به ترتیب ۲۷ و ۶۷۷ درجه سانتیگراد، و شعاع اتمی آن ۲۷۰ پیکومتر است.
مارگوریت پری، فرانسیم را در سال ۱۹۳۹ در فرانسه کشف کرد، به همین دلیل این عنصر فرانسیم نام گرفت. این عنصر آخرین عنصر کشف شدهای است که در طبیعت به طور آزاد وجود دارد و پس از استاتین کمیابترین عنصر شناخته شدهاست.
فرانسیم در بیرون از آزمایشگاه، به طور بسیار ناچیزی در سنگ معدن اورانیوم و توریوم یافت میشود، جایی که ایزوتوپ ۲۲۳ آن به طور پی در پی تشکیل و متلاشی میشود. تخمین زده میشود که حدود ۳۰ گرم فرانسیم در پوسته زمین وجود داشته باشد. سایر ایزوتوپهای فرانسیم به طور مصنوعی و در آزمایشگاه ساخته میشوند. بیشترین مقداری که تاکنون از فرانسیم به طور مصنوعی ایجاد شده، یک خوشه ۱۰٬۰۰۰ اتمی بودهاست که از طریق ابر اتمی سرد و در دانشگاه استونی بروک و در سال ۱۹۹۷ ساخته شدهاست. فرانسیم پس از فروپاشیدن به استاتین، رادیوم و رادون تبدیل میشود.
تاریخچه
در حدود سالهای دهه ۱۸۷۰ شیمیدانها متوجه شدند که باید عنصری با عدد اتمی ۸۷ در گروه فلزات قلیایی زیر سزیم وجود داشته باشد. این عنصر با نام اکا سزیم پیشبینی شد. گروههای پژوهشی تلاششان را برای یافتن و خالصسازی این عنصر ناشناخته آغاز کردند و پس از ۴ تلاش ناموفق، این عنصر ساخته شد.
اکتشافات ناقص و ناتمام
دوبروسردوف شیمیدان روسی اولین شخصی بود که ادعای کشف عنصری به نام فرانسیم یا اکا سزیم را عنوان کرد. در سال ۱۹۲۵ او متوجه وجود رادیواکتیویته ضعیفی در یک نمونه پتاسیم شده و پی برد که این نمونه ممکن است حاوی مقداری از عنصر جدید باشد. سپس او رسالهای در مورد خواص این عنصر نوشت و بخاطر نام کشورش آنرا روسیوم نام گذاری کرد.اندکی پس از آن دوبروسردوف به تدریس در انستیتوی پلیمر اودسای اوکراین پرداخت و تحقیقات بیشتری در زمینه این عنصر به عمل نیاورد.
سال بعد، شیمیدانان انگلیسی جرالد دروس و فردریک لورینگ عکسهای اشعه ایکسمنگنز(II) سولفات را بررسی کردند. آنان در این مشاهده به خطوط طیفی برخورد کردند که گمان میبردند مربوط به اکا سزیم باشد.آنان این کشفیات را اعلام نموده و آنرا آلکالینیوم نامگذاری کردند.
در سال ۱۹۳۰ فرد آلیسون در موسسه پلیتکنیک آلاباما مدعی شد که هنگام بررسی پلوسیت و لپیدولیت با ماشین نور-مغناطیس عنصر ۸۷ را کشف کردهاند.آلیسون پیشنهاد کرد که بخاطر زادگاهش یعنی ایالت ویرجینیا این عنصر ویرجنیوم نامگذاری شود و نماد Vi یا Vm داشته باشد. البته در سال ۱۹۳۴ مک فرسون از دانشگاه برکلی این اکتشاف نادرست را رد کرد.
در سال ۱۹۳۶ هوریا هولوبی شیمیدان فرانسوی به همراه دوست فرانسویاش ایوت کاچویس پولوسیت را با استفاده از دستگاه اشعه ایکس با دقت بالا آنالیز کردند. آنان متوجه وجود چندین خطوط نشر ضعیف شدند که به عنصر ۸۷ نسیت دادند.این عنصر به افتخار مولداوی که آزمایشها در آنجا انجام شد مولداویوم نام گرفت و نماد آن هم Ml تعیین گشت. در سال ۱۹۳۷ تحقیقات هولوبی بوسیلهٔ یک فیزیکدان آمریکایی بنام اف اچ هرش رد شد. هرش اطمینان داشت که اکا سزیم در طبیعت وجود ندارد و آنان به اشتباه خطوط نشر جیوه یا بیسموت را مشاهده کردهاند. اگرچه هولوبی تاکید میکرد که دستگاههای او آنچنان دقیق اند که چنین اشتباهی را مرتکب نمیشوند.
به همین خاطر ژان باپستیت پرین برندهٔ جایزه نوبل و استاد هولوبی به کمک مارگوریت پری مولداویوم را به عنوان فرانسیم مورد تایید قرار داد.
ویژگیها
هستهٔ اتم فرانسیم به علت نایابی و ناپایداری امکان جدا کردن اتمهای فرانسیم به حدی که قابل اندازه گیری باشند نیست به همین دلیل برای خواص آن بیشتر بر روی مکان آن در جدول تناوبی تکیه میکنند.
فرانسیم یکی از فلزهای قلیایی است که ویژگیهای نزدیک به سزیم دارد. فرانسیم ناپایدارتر از هر عنصر سبکتر از دابنیوم (عنصر شماره ۱۰۵) است. پایدارترین ایزوتوپ آن فرانسیم ۲۲۳ با نیم عمر کمتر از ۲۲ دقیقهاست. عنصر ناپایدار بعدی استاتین نیم عمری حدود ۸٫۵ ساعت دارد. تمام ایزوتوپهای فرانسیم پس از فروپاشی به استاتین، رادیوم و رادون تبدیل میشوند.
با توجه به اینکه فرانسیم یکی از عناصر چگال جدول تناوبی است و اینکه تعداد الکترون لایه ظرفیت آن ۱ است، بنابراین وزن اکی والان آن از همه عناصر بیشتر است. به محاسبه لینوس پاولینگ مقدار الکترونگاتیوی فرانسیم باید با سزیم برابر و حدود ۰.۷ باشد گرچه محاسبات جدیدتر مقدار آن را ۰.۷۹ نشان میدهند اما این مقدار به طور تجربی تائید نشدهاست به طور مشابه فرانسیم کمترین الکترونگاتیوی را در بین عناصر دارد.
فرانسیم مایع -در صورتی که تشکیل شود- در دمای ذوبش تنش سطحی برابر ۰٫۰۵۰۹۲ نیوتن بر متر خواهد داشت. فرانسیم همچنین میتواند با بسیاری از نمکهای سزیم مانند پرکلرات، یدات، تارتارات، کلروپلاتینات و سیلیکوتنگستات سزیم (همچنین روبیدیوم تاتارات) واکنش دهد. همچنین با سیلیسیوم تنگستن و کلورپلاتینید واکنش داده و به ترتیب تولید سیلیکو تنگستن اسید و پرکلریک اسید میکند. نمکهای فرانسیم عمدتاً محلول در آب هستند.
اکتینید ها: عنصر های 90 تا 103 جدول تناوبی را تشکیل می دهند .که نام آن ها از فلز اکتینیم (89Ac) گرفته شده است.
در این عنصر ها اوربیتال 5f در حال پر شدن است. ساختار هسته در این عنصر ها نسبت به آرایش الکترونی از اهمیت بیش تری برخوردار است. همه ی اکتنید ها هسته ی ناپایداری دارند و به همین دلیل پرتوزا هستند. برای مثال :
مشهور ترین اکتینید ، اورانیم است که از فرو پاشی هسته ی آن انرژی لازم برای تولید برق در نیروگاه ها ، زیر دریایی ها و ناوهای هواپیما بر فراهم می شود. (اکتینید ها در گروه سوم و دوره ی هفتم جدول تناوبی قرار دارند.
اکتنيدها گروهي از عناصر شيميايي هستند که داراي خواص شيميايي مشابهي مي باشند . اين گروه پانزده عنصر شيميايي را از اکتينيوم (Ac) با عدد اتمي 89 تا لارنسيوم (Lr ) با عدداتمي 103 در بر مي گيرد . عناصر شيمييايي يک گروه در جدول تناوبي بايستي زير يکديگر نوشته شوند . اما به دليل تعداد زياد عناصر اين گروه ، توافق شده است که عناصر گروه اکتنيدها در زير جدول تناوبي وبه صورت يک رديف مستقل نوشته شونداکتنيدها نسبت به لانتانيدها داراي شباهت رفتاري کمتري هستند. اين گروه از عناصر طيف رفتاري گسترده تري را نسبت به در حالتهاي اکسايشي به نمايش مي گذارند و اين مسأله موجب مي شود که اين تصور پيش بيايد که آيا اکتينيوم، توريوم و اورانيوم بايستي به عنوان عناصري از بلوک d در نطظر گرفته شوند. تمامي عناصر موجود در خانواده ي اکتنيدها راديواکتيو هستند
.
اکتنيدها عمدتاً در زير بخش اصلي جدول تناوبي ( زير لانتانيدها) نوشته مي شوند . يکي از ترکيبات آلي فلزي اکتنيدها تحت عنوان «ارگانواکتنيد organoactinod» شناخته مي شود .
فراواني
فقط توريوم و اورانيوم به صورت طبيعي در پوسته ي زمين يافت مي شوند و مقدار آنها قابل توجه است . مقدار ساير عناصر بسيار بسيار ناچيز است و غالب آنها به صورت مصنوعي در آزمايشگاهها تهيه مي شوند و نيمه عمر بعضاً کوتاهي دارند. نپتونيوم و پلوتونيوم نيز در کانه هاي اورانيوم (سنگ معدن) و آن هم در نتيجه ي واپاشي اورانيوم وجود دارند . بقيه ي عناصر مربوط به گروه اکتنيدها – همانطور که گفته شد – به واسطه ي واکنشهاي هسته اي ساخته مي شوند .
تاريخچه
از نخستين عنصر مربوط به خانواده اکتنيدها ، يعني عنصر اکتينيوم با عدد اتمي 89 تا اورانيوم با عدد اتمي 92 که داراي شباهتهايي با فلزات واسطه مي باشند ، فرض بر آن بود که عناصر پس از اورانيوم داراي خصوصيات اينچنيني باشند.
یکي از محققان به نام «مانهاتان پروجکت Manhattan Project» در سال 1944 به همراه يکي ديگر از دانشمندان معاصر خود به نام گلِن ت. سيبورگدر هنگام جداسازي آمريسيوم و کوريم با مشکلات پيش بين نشده اي مواجه شدند. آنها باخود مي انديشيدند که ممکن است اين عناصر به دسته يا خانواده ي ديگري از عناصر جدول تناوبي تعلق داشته باشند . بنابر اين نتيجه گرفتند که با دسته ي جديدي از عناصر جدول تناوبي روبرو شده اند . سپس در سال 1945 و به رغم مخالفت بسياري از همکاران ، آنها سري اکتنيدها را در جدول مندليف که تا آن زمان تغييري نکرده بود ، وارد نمودند. در ادامه ، Seaborg طي مقاله اي اکتنيدها را به عنوان فلزاتي سنگين و با آرايش الکتروني پيچيده معرفي نمود و پيش بيني کرد که اکتنيدها يک دسته يا سري از فلزات واسطه را که شبيه به لانتانيدها باشند ، تشکيل مي دهند .
در سال 1961 يک دانشمند لهستاني به نام Antoni Przybylski ستاره اي را کشف کرد که بعدها معلوم شد اين ستاره داراي مقدار قابل توجهي از عناصر خانواده اکتنيدها مي باشد .اين ستاره HD 101065 نام دارد که البته به افتخار کاشف آن « پريزي بولسکي Przybylski » نيز ناميده مي شود .
سری فلزات اکتینید
در جدول تناوبی دو ردیف در پایین جدول وجود دارد. سری های لانتانید و اکتینید. سری لانتانید ها می توانند به طور طبیعی در خاک یافت شوند. فقط یک عنصر از این سری رادیواکتیو است. سری اکتینید خیلی فرق می کند. همه آنها رادیواکتیو هستند و تعدادی از آنها نیز در طبیعت یافت نمی شوند. بعضی از این عناصر، فقط در آزمایشگاه ها ایجاد شده اند
آشنایی با گروه
پانزده عنصر که با اکتینیوم (Ac) با عدد اتمی 89 شروع و با لارسنیوم(La) با عدد اتمی 103 پایان می یابند. معلمتان هرگز از شما نخواهد خواست که همه عناصر در این سری را حفظ کنید، فقط اکتینیوم را به خاطر بسپارید.
اكتنيدها
دورة هفتم از جدول كه هنوز تكميل نيافته با فلز راديو اكتيو فرانسيم(عنصر فرانسيم به مقدار بسيار ناچيز هم در زنجيره تباهي و تجزيه هستهاي مواد راديواكتيو طبيعي وجود دارد و هم در واكنشهاي هستهاي بوجود ميآيد.) در خانه 87 آغاز ميگردد. سه عنصر اوليه و راديو اكتيو اين دوره بلند يعني فرانسيم، راديم و اكتينيم به ترتيب داراي آرايشهاي سطح ظرفيتيو بوده كه نظير آرايش سه عنصر اوليه دورة قبلي يعنيوميباشد. انتظار ما اين است كه ساختمان الكتروني عناصر بعد از اكتينيم مشابه عناصر دوره قبلي باشد كه به پيدايش 14 عنصر لانتانيد مانند انجاميد. به عبارت ديگر، در لانتانيدها چهارده الكترون متوالياً وارد اوربيتالهايشدند، و در اينجا نيز اين توقع را داريم كه آنها متوالياً واردشوند.
متأسفانه حدس علمي ما درست از آب در نميآيد. زيرا نياز به اطلاعات بيشتري داريم. در دوره ششم وضع روشنتر بود . تـرازضمن اينكه نزديـكبود ولي در اغلب جاها قاطعانه پايينتر از آن بود. در دوره هفتم، ترازهاي انرژيبه اندازهاي به يكديگر نزديك ميشوند كه توازن ميان آن دو يادآور عمليات بندبازي است! كوچكترين تغيير در شرايط، به نفع يك طرف و به ضرر ديگري تمام ميشود، در نتيجه الكترونها گاهي درو زماني دروارد ميگردند. در مواردي از قبيل در خانه 91، چنان توازني بر قرار ميشود كه نميتوان به دقت گفت كه آرايش حالت پايه اين عنصر ،،و يا است! شايد بتوان گفت كه در نيمه دوم اين سري جديد معروف به اكتينيدها، تراز انرژي اغلب، پايينتر از است. (نوسانات و آرايشهاي غير قابل پيش بيني عناصر اين دوره) با وجود اينها ميتوان گفت كه روند كلي تغييرات اكتينيدها و لانتانيدها، كم و بيش مشابه است.
لورنسيمكه آرايش را دارد، آخرين عنصر اكتينيد است. انتظار ميرود عناصري كه اخيراً كشف شده مانند عنصر شمارة 104 معروف به كورچاتوويم و عنصر 105 معروف به هانيم ، به علت ورود متوالي آخرين الكترونهاي آنها در، به تدريج چهارمين سري عناصر واسطه جدول تناوبي را تشكيل دهند.
هرگاه نمودارهايرا مقايسه كنيم، به نتيجة جالبي مي رسيم. شيب نزولي تراز اوربيتالهايخيلي كمتر ازاست. علت را بايد در كاهش شديد قابليت نفوذ آنها نسبت به رقيبان خود يعني اوربيتالهاي جستجو كرد. مسئله ديگر اين است كه در روندي مشابه روند قبلي، ديده ميشود كه اوربيتالهايو اوربيتالهاي توانايي نفوذ خوبي به سوي خارج يعني در جهت اوربيتال ندارند. از اينرو و با اين در هم آميختن با اوربيتالهاي دروني، به پايداري بيشتري ميرسند. به عبارت ديگر، تراز انرژي آنها نسبت به اوربيتال ، پايينتر است و الكترونها در آنها وارد ميشوند.
عناصر گروه دوم جدول تناوبی که به فلزات قلیایی خاکی معروفند در لایه ظرفیت الکترونی ، دارای آرایش nS2 هستند. آخرین عنصر این گروه یعنی رادیوم ، رادیواکتیو است. این فلزات سطحی درخشان و رنگ نقرهای سفید دارند. دارای واکنشپذیری بالایی هستند. اما واکنشپذیری این گروه به اندازه فلزات قلیایی استخراج فلزات قلیایی خاکی در پوسته زمین یافت میشوند. اما نه بصورت فلز آزاد بلکه بعلت فعالیت بالا بصورت ترکیب در کانیها و سنگهای مختلف. کلسیم ، پنجمین عنصر فراوان در پوسته زمین و منیزیم هشتمین عنصر فراوان در پوسته زمین است. کانیهای مهم منیزیم عبارتند از: کارنیت ، منیزیت و دولومیت. منیزیم از آب دریا هم استخراج میشود. با افزودن هیدروکسید کلسیم به آب دریا هیدروکسید منیزیم کم محلول بصورت رسوب تهنشین میشود. این رسوب بعد از تبدیل به کلرید منیزیم در سلول الکتروشیمیایی داونز الکترولیز میشود تا منیزیم فلزی بدست آید. منابع عمده کلسیم ، کالک ، سنگ آهک ، ژیپس ( سنگ گچ ) بیآب است. خواص فیزیکی این فلزات سختتر و چگالتر از فلزات گروه اول هستند. دمای ذوب بالایی دارند. این خواص آنها تا حد زیادی ناشی از وجود دو الکترون در لایه ظرفیت است که پیوندهای قویتری از فلزات گروه I ایجاد میکنند. منیزیم ، کلسیم ، استرانسشیم و باریم از این گروه در اثر حرارت در شعله ایجاد رنگ میکنند. منیزیم: سفید درخشان کلسیم: قرمز آجری استرانسیم: قرمز خونی باریم: سبز شعاع اتمی و یونی بطور یکنواخت از بالا به پایین افزایش مییابد. شعاع یونی خیلی کوچکتر از شعاع اتمی است و این بعلت وجود دو الکترون در لایه S است که با از دست دادن آنها و ایجاد کاتیون M+2 بار مؤثر هسته بر الکترونهای تراز کامل بیشتر شده و این باعث کاهش اندازه یون میشود. خواص شیمیایی از بالا به پایین این فلزات ، الکتروپزیتیوتر میشوند. واکنش با اکسیژن و کلر شدید است. تمام فلزات بجز بریلیم در دمای اتاق در معرض هوا اکسید شده و رنگشان تیره میشود. بریلیم بعلت واکنشپذیری بالا در زیر نفت نگهداری میشود. همه فلزات این گروه بجز بریلیم آب و اسیدهای ضعیف را به هیدروژن کاهش میدهند. منیزیم بکندی با آب واکنش میدهد مگر اینکه آب داغ باشد. ولی کلسیم بشدت در دمای اتاق با آب واکنش داده و سوسپانسیون ابری سفیدی از هیدروکسید کلسیم تولید میکند. کلسیم ، استرانسیم و باریم در اثر حرارت با هیدروژن ترکیب شده و آنرا به فرم هیدرید احیاء میکند. فلزات این گروه در اثر گرم شدن عامل احیاء کننده قوی برای احیاء نیتروژن به فرم نیترید هستند . منیزیم در CO2 سوخته و آنرا به کربن احیاء میکند. یعنی آتش منیزیم با CO2 خاموش نمیشود. اکسید اکسید این فلزات به فرمول عمومی MO بوده و یک اکسید بازی است و از حرارت کربنات یا هیدروکسید این فلزات با آزاد کردن CO2 تولید میشود. اکسید این فلزات انرژی شبکه و دمای ذوب بالایی دارند. بجز بریلیم بقیه دارای فرم پراکسید MO2 هم هستند، چون کاتیون Be+2 برای ایجاد پراکسید بسیار کوچک است. اکسیدهای کلسیم ، استرانسیم ، باریم با آب واکنش داده و هیدرو اکسید تولید میکنند. هیدروکسید کلسیم که به آب آهک معروف است، بطور نسبی در آب محلول بوده و یک محلول بازی متوسط میدهد که برای شناسایی گاز CO2 بکار میرود. هالید هالیدهای این گروه از فلزات به فرم هیدراته یافت میشوند. بجز کلرید بریلیم ، همگی ترکیب یونی هستند. کلرید کلسیم بیآب میل شدیدی به جذب آب دارد و بعنوان خشک کننده استفاده میشود. حالت اکسیداسیون فلزات قلیایی خاکی در تمام ترکیباتی که تشکیل میدهند حالت اکسیداسیون +2 دارند. بجز چند استثنا همه ترکیبات آنها یونی است. این فلزات دو الکترون در لایه آخر دارند که از دست دادن آنها نسبتا آسان است. اما برداشتن الکترون سوم بسیار مشکل است و به انرژی بالایی نیاز دارد، زیرا تحت جاذبه شدید هسته بوده و از لایه هشت تایی کامل برداشته میشود. بنابراین کاتیون این فلزات به فرم M+2 است. اطلاعات صنعتی از میان فلزات این گروه فقط منیزیم بطور گسترده تولید میشود.از این فلز ، بدلیل داشتن شعله سفید و درخشان در ترکیب منومرها ، فشفشهها و گلولههای نورانی ردیاب و بمبهای آتشزا استفاده میشود. منیزیم با آلومینیوم آلیاژی با دانسیته پایین و دوام بالا ایجاد میکند که در صنایع هواپیماسازی کاربرد دارد. اکسید منیزیم بدلیل دمای ذوب بالا در بدنه کورهها استفاده میشود.
فسفر یک عنصر جامد به رنگ سفید واکسی می باشد که در سال 1669توسط Hennig Brand از کشور آلمان کشف شد . این عنصر از سنگهای فسفاته بدست می آید .
فسفر دارای 4 آلوتروپی می باشد. این آلوتروپی ها به فرمهای سفید یا زرد، قرمز، سیاه یا بنفش می باشد. فسفر معمولی مومی شکل سفید رنگ و جامد است. فسفر زمانی که خالص باشد بیرنگ و شفاف است . فسفر سفید دو حالت دارد آلفا و بتا با دمای تبدیل -3.8oC .
این عنصر در آب حل نمی شود اما در دی سولفید کربن حل می شود. این عنصر به خودی خود در هوا آتش می گیرد و بعد از ترکیب با اکسیژن هوا در زمان سوختن تبدیل به پنتا اکسید فسفرمی شود .
این عنصر به حالت آزاد در طبیعت یافت نمی شود ترکیبات این عنصر به صورت گسترده ای در طبیعت پراکنده شده اند. سنگ فسفات حاوی کانی آپاتیت دارای ناخالصی تری فسفات کلسیم است که این سنگ مهمترین منبع تولید فسفر است. معادن بزرگ این عنصر در روسیه، مراکش و فلوریدا و بعضی ازایالتهای دیگر آمریکا یافت می شود .
فسفر عنصری بسیار سمی است 50 میلی گرم آن برای مرگ کافی است. پرتودهی این عنصر از 0.1 میلیگرم بر متر مکعب تجاوز نمی کند. فسفر سفید در زیر آب نگهداشته می شود باید آن را با انبر جابجا کرد تماس آن با پوست دست باعث سوختگی شدید می شود.
وقتی در معرض نور خورشید قرار بگیرد یا وقتی داغ شده باشد حرارت آن به 250 درجه می رسد که می تواند در این حالت تبدیل به فسفات نوع قرمز شود. این فرم از فسفر به راحتی و به خودی خود آتش نمی گیرد و به اندازه فسفر سفید خطرناک نیست. در موقع کار با فسفر سفید باید بسیار دقت کرد چون هم بسیار سمی است و هم به راحتی درجه حرارت آن بالا می رود و آتش می گیرد. فسفر قرمز نسبت به سفید دارای پایداری بیشتری می باشد و برای ساخت کبریتهای بی خطر، مواد آتش بازی ، آفت کشها ، آتش افروزها ، بمبهای دودزا و گلوله ها کاربرد دارد.
فسفر سفید به روشهای مختلفی ساخته می شود. تری فسفات کلسیم یکی از اجزای اصلی سنگ فسفر است که در کوره های برقی یا سوخت کوره کاربرد دارد.
اسید فسفریک غلیظ که حاوی 70 تا 75 درصد P2O5 است عامل مهمی در تولیدات کشاورزی و مزرعه می باشد. از این عنصر برای تهیه کودهای شیمیایی کاربرد دارد. فسفاتها در تولید شیشه های مخصوص مثل لامپهای سدیم کاربرد دارد. فسفات کلسیم در ساخت ظروف چینی و پودر خمیرمایه استفاده می شود.
فسفرها یکی از مهمترین عامل تولید فولاد و فسفر برنز و تولیدات مهم دیگر می باشد. تری سدیم فسفات عامل پاک کننده در تصفیه آب و دیگ بخارمی باشد. فسفر ها عامل حیاتی در پروتوپلاسم همه سلولها، بافت های عصبی و استخوانها هستند.
ساختار بلوری عنصر فسفر
اثرات فسفر بر سلامتی انسان
فسفر در مقایسه با فسفات در محیط زیست از فراوانی بیشتری برخوردار است. فسفات ها یکی از مهمترین مواد تشکیل دهنده بدن انسان به شمار میروند. زیرا فسفاتها قسمتی از ماده DNA را تشکیل میدهند و در توزیع انرژی بدن شرکت میکنند. همچنین فسفاتها از اجزای تشکیل دهنده گیاهان هستند.
انسان با افزودن کودهای غنی از فسفات به خاک و با استفاده از شوینده های حاوی فسفات باعث افزایش مقدار فسفات در طبیعت میشود. همچنین، فسفات یکی از مواد افزودنی به مواد غذایی به شمار میرود. مواد غذایی مانند پنیر، سوسیس و همبرگرها دارای مقدار قابل توجهی فسفات هستند.
مقدار زیاد فسفات باعث بیماریهایی از قبیل آسیب به کلیه ها و پوکی استخوان میشود. از طرفی ممکن است در بدن فردی کمبود فسفات رخ دهد. کمبود فسفات بر اثر استفاده بیش از اندازه دارو اتفاق می افتد. مقدار بسیار اندک فسفات نیز آسیبهایی را به سلامت انسان وارد میکند.
فسفرخالص به رنگ سفید است. فسفر سفید خطرناکترین شکل فسفری است که تاکنون شناخته شده است. اگر فسفر سفید در محیط وجود داشته باشد احتمال خطر و تاثیر آن بر سلامت انسان افزایش می یابد. فسفر سفید بسیارسمی است و در بسیاری موارد پرتودهی آن کشنده میباشد.
بیشتر موارد مرگ گزارش شده بر اثر فسفر سفید به دلیل بلع مرگ موش میباشد. علائمی مانند استفراغ، گرفتگی معده و خواب آلودگی قبل از مرگ در فرد مشاهده میشود.
فسفر سفید باعث سوختگی پوست میشود. در حین سوختگی پوست قسمتهایی از بدن مانند کبد، قلب و کلیه ها آسیب میبینند.
اثرات فسفر بر محیط زیست
فسفر سفید
با تولید مواد شیمیایی در صنایع مختلف و تولید مهمات در ارتش مقداری فسفر سفید وارد محیط میشود. با تخلیه فضلاب کارخانه ها مقداری فسفر سفید وارد آبهای سطحی نزدیک کارخانه میشود.
به نظر میرسد که فسفر سفید در محیط منتشر نمیشود زیرا به سرعت با اکسیژن هوا واکنش میدهد. با ورود فسفر سفید به هوا و ترکیبش با اکسیژن، فسفر سفید به ذراتی تبدیل میشود که اثر مخرب کمتری دارد. زیرا زمانیکه ذرات فسفر در هوا قرار دارند، پوشش محافظی آنها را دربرگرفته و از واکنش دادن با سایر مواد جلوگیری میکند.
فسفر سفید در آب با سایر مواد وارد واکنش نمیشود و در نتیجه داخل بدن موجودات آبی تجمع پیدا میکند. در خاک فسفر طی چند روز باقی می ماند و سپس به مواد با خطر کمتر تبدیل میشود. اما در خاکهای عمیق و در اعماق رودخانه ها و دریاچه ها ممکن است فسفر حدود چند هزار سال باقی بماند.
فسفاتها
فسفات اثرات زیادی بر موجودات زنده دارد. اثر فسفات نتیجه انتشار وسیع آن در محیط زیست به دلیل معدنکاری و کشت و زرع میباشد. در هنگام تصفیه آب معمولاً فسفات از بین نمیرود، بنابراین فسفات میتواند در مسافت زیادی از طریق آبهای سطحی انتشار پیدا کند.
با توجه به مقدار اضافه فسفر در طبیعت که به دلیل فعالیتهای انسانی اتفاق افتاده است و به دلیل افزایش غلظت فسفر، در چرخه فسفر اختلالاتی پدید آمده است.
با افزایش غلظت فسفر در آبهای سطحی، تعداد ارگانیسمهای وابسته به فسفات افزایش می یابد. این ارگانیسمها عبارت هستند از جلب و خزه. این ارگانیسمها مقدار زیادی از اکسیژن محیط را مصرف میکنند و از وارد شدن نور خورشید به آب جلوگیری میکنند. این مسئله باعث میشود که سایر موجودات زنده نتوانند در آب زندگی کنند. به این پدیده eutrophication گفته میشود.
نیتروژن عنصر شیمیائی غیر فلزی با الکترونگاتیویته 3 است که در جدول تناوبی با نشانه N مشخص می شود و دارای عدد اتمی 7 می باشد . این گازدر سال توسط Daniel Rutherford از کشور اسکاتلند کشف گردید و 78% ترکیبات اتمسفر را شکل می دهد این گاز از مایع سازی هوا و گرم کردن NaN3 بدست می آید .
2.6 درصد از ترکیب سیاره بهرام را نیتروژن تشکیل می دهد. از دیگر منابع نیتروژن اتمسفر است که نیتروژن گازی را از جو می توان با روشهای مایع شدن و تقطیر جز به جز به دست آورد. نیتروژن در همه سیستمهای حیاتی و همه ترکیبات زیستی یافت می شود.
یک شیمیدان فرانسوی به نام Antoine Laurent Lavoisier اشتباهاً نام ازت را به معنی مرده یا بدون حیات روی نیتروژن گذاشت. به هر حال ترکیبات نیتروژن در غذاها، مواد آلی، کودها، مواد سمی و مواد منفجره یافت می شود. نیتروژن گاز بی رنگ، بی بو، و در حالت عادی بی اثر است. نقطه جوش آن 195.80 درجه است. این گاز می تواند توسط واکنش آب و نیتریت آمونیوم تولید شود. نیترات سدیم و نیترات پتاسیم از تجزیه ترکیبات آلی حاصل می شود. نیترات پتاسیم در مناطق خشک دنیا برای استفاده کودهای ازتی یافت می شود. از دیگر ترکیبات نیتروژن آلی اسید نیتریک، آمونیاک، سیانیدها و اکسیدهای نیتروژن هستند.
چرخه نیتروژن یکی از مهمترین فرایندها در طبیعت برای ارگانیسمهای زند ه است. این چرخه باکترهای نیتروژن دار را به نیتروژن گازی تبدیل می کند. نیتروژن و ترکیبات پروتئینی نقش تعیین کننده در حیات انسانها را دارند.
آمونیاک یکی از مهمترین ترکیبات نیتروژن است. که توسط فرایندهای هابر تولید می شود. گاز طبیعی متان در واکنش دی اکسید کربن و هیدروژن گازی در دو مرحله حاصل می شود. هیدروژن گازی و نیتروژن گازی در فرایند هابر تولید آمونیاک می کنند. این گاز بیرنگ دارای بوی تیز است و به آسانی به مایع تبدیل می شود.
اثرات نیتروژن بر سلامتی انسان
مقدار مولکولهای نیتروژن در هوا زیاد است. نیتروژن در آب و خاک به صورت نیترات و نیتریت پیدا میشود. کلیه این مواد بخشی از چرخه نیتروژن به حساب می آیند، اگر چه همه این اشکال نیتروژن با یکدیگر در ارتباط هستند.
انسان خصوصیات نیترات و نیتریت طبیعی را تغییر داده است. این تغییرات بالاخص در کودهای شیمیایی نیتروژن دار اتفاق افتاده است. شرکتهای صنعتی با نیتروژنی که تولید میکنند میزان نیترات و نیتریت خاک و آب را که نتیجه چرخه نیتروژن میباشند را تغییر میدهند. به دلیل این فعالیتها غلظت نیترات در آب آشامیدنی افزایش می یابد.
نیتراتها و نیتریتها بر سلامت انسان تاثیر دارند. این اثرات عبارت هستند از:
واکنش با هموگلوبین خون، این امر باعث کاهش توانایی خون برای انتقال اکسیژن میشود (نیتریت).
عملکرد غده تیروئید را کاهش میدهد (نیتریت).
سبب کمبود ویتامین A میشود (نیتریت).
nitrosamines از عوامل عمده ایجاد کننده سرطان محسوب میشوند (نیتراتها و نیتریتها).
از نقطه نظر متابولیسمی، اکسید نیتروژن نسبت به عنصر شیمیایی نیتروژن به تنهایی از اهمیت بیشتری برخوردار است. در سال 1987، Salvador Moncada کشف کرد که اکسید نیتروژن برای آرامش عضلات بدن بسیار حیاتی است و امروزه میدانیم که اکسید نیتروژن در سیستم قلبی – عروقی، سیستم ایمنی، سیستم عصبی مرکزی و سیستم عصبی جانبی وجود دارد. آنزیم تولید کننده اکسید نیتروژن، synthase اکسید نیتروژن نامیده میشود و در مغز انسان به مقدار زیاد وجود دارد.
اگر چه اکسید نیتروژن دوره عمر کوتاهی دارد، لیکن میتواند به اجزای تابع خود تبدیل شود.
اثرات زیست محیطی نیتروژن
انسان با فعالیتهایی که انجام داده است باعث تغییر مقدار نیتریت و نتیرات در طبیعت گشته است. عمده ترین عامل افزایش مقدار نیترات و نیتریت در محیط زیست کودهای شیمیایی هستند. فرآیند احتراق سبب افزایش نیترات و نیتریت میشود، زیرا بخارات متصاعد شده از اکسیدهای نیتروژن در محیط زیست به نیترات و نیتریت تبدیل میشوند.
طی تولیدات شیمیایی، نیترات و نیتریت تشکیل میشوند و برای کنسرو کردن مواد غذایی مورد استفاده قرار میگیرند. همین مسئله سبب افزایش غلظت ترکیبات نیتروژن در آبهای سطحی و زیرزمینی و به تبع آن در غذا میشود.
افزایش پیوندهای نیتروژنی در محیط زیست سبب اثرات متنوعی میشود. یک، تنوع در پیوند شیمیایی باعث تغییر در ترکیب شیمیایی گونه های مختلف موجودات زنده میگردد. ثانیاً نیتریت اثرات مختلفی بر زندگی انسان و جانوران میگذارد. غذای غنی از ترکیبات نیتروژن سبب کاهش انتقال اکسیژن خون شده و عواقب وخیمی برای گله های گاو دربردارد.
با افزایش غلظت نیتروژن مشکلاتی در غده تیروئید رخ میدهد و همچنین مقدار ذخیره ویتامین A کاهش می یابد. در معده و روده جانوران نیترات به nitrosamines تبدیل میشود و یک ماده خطرناک سرطانزا را تولید میکند.
خواص فیزیکی و شیمیایی عنصر نیتروژن :
عدد اتمی:7
جرم اتمی: 14.00674
نقطه ذوب : C°-210.0
نقطه جوش: C°-195.7
شعاع اتمی : Å 0.75
ظرفیت:5
رنگ: بی رنگ
حالت استاندارد: گاز
نام گروه: 15
انرژی یونیزاسیون : Kj/mol 1402.3
شکل الکترونی: 1s2 2s22p3
گازهای نجیب بی رنگ و بی بو بوده و در گروه A8 جدول مندلیف قرار دارند. این گروه گازها شامل هلیم ، نیون ، آرگون ، کریپتون ، زنون و رادون است. به استثنای هلیم ، تمام گازهای نجیب دارای آرایش الکترونی خارجی ns2 np6 هستند که آرایشهای بسیار پایدارند. تا سال 1960، تصور می شد که این گازها به علت داشتن عدد اکسیداسیون صفر بی اثر بوده و تمایل به تشکیل ترکیب ندارند. تمامی گازهای نجیب ماکزیمم تعداد الکترون را در لایه بیرونی(آخر) الکترونی خود دارا بوده ( گاز هلیم 2 و بقیه گازها 8 الکترون) و تمایلی خیلی اندکی به گرفتن یا از دست دادن الکترون دارند که همین خاصیت موجب پایداری آنها شده است. در مورد گازهای هلیم، نئون و آرگون ترکیبی شناخته شده ای ثبت نشده ولی کریپتون در واکنش با فلوئورین تشکیل جامد بی رنگ می دهد. زنون هم تشکیل ترکیبات زیادی با اکسیژن و فلوئورین می دهد. ﺧﻮﺍﺹ ﻭ ﺗﺮﻛﻴﺒﻬﺎ ﺗﺎ ﺳﺎﻝ 1962 ﺗﺼﻮﺭ ﻣﻲﺭﻓﺖ ﻛﻪ ﺍﻳﻦ ﮔﺎﺯﻫﺎ ﺩﺭ ﻭﺍﻗﻊ ﺍﺯ ﻧﻈﺮ ﻓﻌﺎﻟﻴﺖ ﺷﻴﻤﻴﺎﻳﻲ ﺑـﻲﺍﺛﺮﻧـﺪ ﻭﻟـﻲ ﺩﺭ ﺁﻥ ﺳﺎﻝ ﺑﺎﺭﺗﻠﺖ، ﺑﺎ ﺗﻬﻴﻪ ﺗﺮﻛﻴﺒﻲ ﺑﻪ ﻓﺮﻣﻮﻝ O2PtF6 (ﺑﻠﻮﺭﻫﺎﻱ ﻗﺮﻣﺰ ﻧﺎﺭﻧﺠﻲ) ﻭ ﺑﺎ ﺗﻮﺟﻪ ﺑﻪ ﺍﻳﻨﻜﻪ ﺍﻧﺮﮊﻱ ﻳﻮﻧﺶ Xe , O2 ﺑﻬﻢ ﻧﺰﺩﻳﻚ ﺍﺳﺖ (ﺣﺪﻭﺩ 279 ﻛﻴﻠﻮﻛﺎﻟﺮﻱ ﺑﺮ ﻣﻮﻝ) ﺑﻪ ﻓﻜﺮ ﺗﻬﻴﻪ O2PtF6 ﺍﻓﺘﺎﺩ ﻭ ﺳﺮﺍﻧﺠﺎﻡ ﺁﻥ ﺭﺍ ﺑﻪ ﺻﻮﺭﺕ ﺑﻠﻮﺭﻫﺎﻱ ﺯﺭﺩ ﺭﻧﮓ ﺑﺪﺳﺖ ﺁﻭﺭﺩ. ﺑﻪ ﺗﺪﺭﻳﺞ ﺗﺮﻛﻴﺒﻬﺎﻱ ﺩﻳﮕﺮﻱ ﺍﺯ Xe ﺑﺪﺳﺖ ﺁﻣﺪ ﻛﻪ ﺑﻴﺸﺘﺮ ﺁﻧﻬﺎ ﺭﺍ می توان از XeF6 (ﻛﻪ ﺧﻮﺩ ﻣﺎﻧﻨﺪ ﺳﺎﻳﺮ ﻓﻠﻮﺋﻮﺭﻳﺪﻫﺎﻱ ﺯﻧﻮﻥ ﺍﺯ ﺗﺮﻛﻴﺐ ﻣﺴﺘﻘﻴﻢ ﺩﺭ ﺩﻣﺎﻱ ﻗـﻮﺱ ﺍﻟﻜﺘﺮﻳﻜـﻲﺣﺎﺻﻞ ﻣﻲﺷﻮﻧﺪ) ﺑﺪﺳﺖ ﺁﻭﺭﺩ. ﻓﺮﻣﻮﻝ ﻭ ﺳﺎﺧﺘﺎﺭ ﺑﺮﺧﻲ ﺍﺯ ﺍﻳﻦ ﺗﺮﻛﻴﺒﻬﺎ ﺩﺭ ﺟﺪﻭﻝ ﺯﻳﺮ ﻧﺸﺎﻥ ﺩﺍﺩﻩ ﺷﺪﻩ ﺍﺳﺖ. منبع اصلی گازهای نجیب اتمسفری تئوری های فعلی پیشنهاد می کنند گاز آرگون موجود در اطراف زمیت از ماگماهای آتش فشانی تولید شده است، اما دانشمندان موسسه ی پلی تکنیک رنسلیر نیویورک که نتایج بررسی های خود را در مجله ی نیچر منتشر کرده اند، تحقیقات جدیدی را در این خصوص انجام داده اند.محققان فرضیه ای را مطرح کردند مبنی بر این که این گاز می تواند از پوسته ی اقیانوسی آزاد شده باشد. در حقیقت پوسته ی اقیانوسی برعکس پوسته ی زمینی از کانی هایی ساخته شده است که غنی از آرگون هستند. ﺭﻭﺵ ﺗﻬﻴﻪ ﺁﺭﮔﻮﻥ، ﻧﺌﻮﻥ، ﻛﺮﻳﭙﺘﻮﻥ ﻭ ﺯﻧﻮﻥ ﺍﻭﻟﻴﻦ ﺑﺎﺭ ﺑﻴﻦ ﺳـﺎﻟﻬﺎﻱ 1894 ﺗـﺎ 1898 ﺗﻮﺳـﻂ ﺭﺍﻣـﺴﻲ، ﺭﺍﻳﻠـﻪ ﻭ ﺗﺮﺍﻭﺭﺱ ﺍﺯ ﺭﺍﻩ ﺗﻘﻄﻴﺮ ﺟﺰﺀ ﺑﻪ ﺟﺰﺀ ﻫﻮﺍﻱ ﻣﺎﻳﻊ ﺑﺪﺳﺖ ﺁﻣﺪﻧﺪ. ﺭﺍﺩﻭﻥ ﺍﺯ ﺭﺍﻩ ﻭﺍﻛﻨﺸﻬﺎﻱ ﻭﺍﭘﺎﺷﻲ ﺭﺍﺩﻳﻮﺍﻛﺘﻴـﻮﻱ ﺗﻮﺭﻳﻢ ﻭ ﺭﺍﺩﻳﻢ ﺗﻮﺳﻂ ﺩﻭﺭﻥ ﺩﺭ 1900 ﻛﺸﻒ ﺷﺪ ﻛﺎﺭﺑﺮﺩﻫﺎﻱ ﻣﻬﻢ • ﺩﺭ ﺗﻬﻴﻪ ﺗﺎﺑﻠﻮﻫﺎﻱ ﻧﺌﻮﻥ (ﻫﻠﻴﻢ: ﺯﺭﺩ، ﻧﺌﻮﻥ: ﻗﺮﻣﺰ، ﺁﺭﮔﻮﻥ: ﻗﺮﻣﺰ ﻳﺎ ﺁﺑﻲ، ﻛﺮﻳﭙﺘﻮﻥ: ﺳﺒﺰ ﻣﺎﻳﻞ ﺑﻪ ﺁﺑﻲ ﻭ ﺯﻧﻮﻥ: ﺁﺑﻲ ﻣﺘﻤﺎﻳﻞ ﺑﻪ ﺳﺒﺰ). • ﺗﻬﻴﻪ ﻫﻮﺍﻱ ﺗﻨﻔﺴﻲ ﺑﺮﺍﻱ ﻏﻮﺍﺻﻲ، ﺭﻗﻴﻖ ﻛﺮﺩﻥ ﺍﻛﺴﻴﮋﻥ ﺑﺮﺍﻱ ﺗﻨﻔﺲ ﺑﻴﻤﺎﺭﺍﻥ ﻣﺒﺘﻼ ﺑﻪ ﺁﺳـﻢ ﻭ ﺟﻮﺷﻜﺎﺭﻱ. • ﺗﻬﻴﻪ ﻻﻣﭙﻬﺎﻱ ﻓﻠﻮﺭﺳﺎﻥ ﻭ ﻻﻣﭙﻬﺎﻱ ﻣﻌﻤﻮﻟﻲ ...
مندلیف حدود 3۰ خانه از جدول را خالی گذاشت و 6۴ عنصر کشف شده تا آن زمان را در جدول تناوبی خود جای داد. اما مجموع این عناصر با هم 9۴ عنصر می شود. در صورتیکه تاکنون با احتساب عناصری که نیمه عمر بسیار کمی دارند، شمار عناصر شناخته شده به 116 رسیده است.اما نبوغ مندلیف به خاطر این بود که عناصر زیادی هم بودند که هنوز شناخته نشده بودند و مندلیف هم هیچ جایی برای آنها در نظر نگرفته بود، اما جدول طوری تنظیم شده بود که افزودن خانه های بعدی به جدول به راحتی امکان پذیر شد.مندلیف هنگام تنظیم جدول تناوبی خود بعضی از خانه ها را خالی گذاشت وادعا كرد این خانه های خالی متعلق به عناصری است كه هنوز كشف نشده است . او حتی خواص این عناصر را پیشگویی كرد مندلیف هنگام تنظیم جدول خود اصل تشابه (( خواص عنصر ها در یك گروه )) را بر اصل افزایش تدریجی جرم اتمی برتری داد ینعی اگر عنصر هایی كه بر اساس افزایش تدریجی جرم اتمی باید زیر هم در یك گروه قرار می گرفتند از لحاظ خواص شیمیایی با یكدیگر تفاوت داشتند مندلیف جای عنصر را در جدول خالی گذاشته و عنصر با جرم اتمی بیشتر را در گروهی قرار می داد كه خواص شیمیایی آن ها متشابه بود . همچنین در بعضی موارد مندلیف مجبور شد ، برای رعایت اصل تشابه خواص در یك گروه اصل افزایش تدریجی جرم اتمی را نادیده گرفته و اتم سبك تر را جلوتر از اتم سنگین تر قرار دهد . به عنوان مثال در جدول تناوبی عنصر كبالت (( با جرم اتمی بیشتر )) جلوتر از عنصر نیكل (( با جرم اتمی كمتر )) آمده بود و یا عنصر تلوریم (( با جرم اتمی بیشتر )) جلوتر از عنصر ید ((با جرم اتمی كمتر)) آمده بود. مندلیف این استثنا ها را به خطای اندازه گیری در محاسبه ی جرم اتمی عنصر ها نسبت داد. همچنین در زمان تنظیم جدول تناوبی مندلیف ، هنوز گازهای بی اث یا نادر شناخته نشده بود. از این رو، در متن جدول اصلی مندلیف نیز جایی برای آنها پیش بینی نشده بود. اما با توجه به نبوغ مندلیف در تنظیم جدول، این امر اشکالی به وجود نیاورده بود. به طوری که هنگامی که رامسی و رایلی در سال 1894 گاز آرگون را کشف کردند و تا سال 1908 گازهای بی اثر دیگر نیز کشف شد، ابتدا آنها را پیش از فلزهای قلیایی در ستون جداگانه ای به نام گروه صفر قرار دادند و بعد از کشف ساختار اتم و با توجه به آرایش الکترونی اتمها، آنها را به آخر جدول منتقل کردند. اما سه عنصر معروف که مندلیف جای و حتی خواص شیمیایی آنها را پیش بینی کرد، همان گالیم و اسکانیدم و ژرمانیم است که مندلیف آنها را به ترتیب اکا آلومینیم، اکابور و اکاسیلیسم نامیده بود.
موارد مصرف لیتیم کدام است؟
شایعترین مورد مصرف این دارو در بیماری افسردگی دو قطبی یا مانیک دپرسیو می باشد. این دارو را در هر دو فاز افسردگی و شیدایی (مانیا) مصرف می گردد
لیتیم قادر است تا 80% با مصرف منظم آن از عود بیماری دو قطبی پیشگیری نماید.
این دارو هم در مرحله حاد بیماری که معمولا بیمار در بیمارستان بستری می گردد و نیز در مرحله نگهدارنده ( یعنی مرحله ای که بیماری در مرحله خاموش قرار دارد، مصرف می گردد. به عبارتی هم اثر درمان مرحله حاد بیماری را دارد و هم قادر است از عود فاز ماینا و افسردگی جلوگیری نماید
مقدار و نحوه مصرف چگونه است؟
معمولا این دارو روزانه 3 تا 4 عدد تجویز می شود، اما روانپزشکان مقدار مصرف دارو را بر اساس سطح خونی دارو تنظیم می کنند. سطح خونی دارو بر حسب فاز بیماری تفسیر می شود. در مرحله حاد بیماری بهتر است بین 0.8 تا 1.2 میلی اکی والان در لیتر و در مرحله غیر حاد یا خاموش بیماری بین 0.6 تا 0.8 تنظیم شود بهتر است
عوارض دارو
عوارض گوارشی. تهوع، استفراغ و اسهال. مصرف دارو به همراه غذا این عوارض را کاهش میدهد
لرزش دستها. کاهش دور دارو، تقسیم دارو در سه وعده در روز، تجویز داروهایی مانند پروپرانولول و پیریمیدون می تواند موثر باشد
چاقی. مصرف زیاد آب و یا احتمالا بروز کم کاری تیروئید می تواند از علل آن باشد
افزایش ادرار. این عارضه شایع است و ممکن است در 30% بیماران دیده شود. با مصرف دارو ها در یک دوز و افزایش مصرف مایعات روزانه
کم کاری غده تیروئید. در 10% کسانیکه لیتیم مصرف می کنند دیده می شود.تجویز لووتیروکسین می تواند موثر باشد
عوارض پوستی. مانند جوش هایی شبیه جوش غرور، تشدید پسوریازیز، ریزش مو
مسمومیت با لیتیم
مسمومیت با این دارو با سطح خونی برابر یا بالاتر از 1.5 میلی اکی والان در لیتر شروع می شود. نزدیکی سطح درمانی (0.8 تا 1.2 ) با سطح خونی مسمومیت این دارو نیاز به دقت بیشتری در تجویز این دارو دارد
علایم مسمومیت خفیف: استفراغ، سرگیجه، نیستاگموس (حرکات غیر ارادی چشم ها)
علایم در حد متوسط شامل بی اشتهایی، تاری دید، پرش های اندام ها، اختلال هوشیاری
علایم در حد شدید مانند تشنج و کما میباشد
حاملگی و مصرف لیتیم
تجویز لیتیم به ویژه در سه ماه ممنوع است. خطر عوارض قلبی در جنین 20 برابر افزایش می یابد.
پس از زایمان نیز از انجائیکه لیتیم در شیر مادر وجود دارد بهتر است لیتیم تجویز نگردد یا در صورتیکه به علت خطر عود بیماری پس از زایمان ،که احتمال آن زیاد است، لازم نوزاد از شیر خشک تغذیه شود
تداخل دارویی
نظر به اینکه مصرف توام داروها ممکن است سطح لیتیم را در خون تغییر دهد بهتر است در این مورد با پزشک خود مشورت نمایید. اما بهتراست بدانید که مصرف چای و قهوه سطح لیتیم را کاهش میدهد پس بهتر است حداقل در نوشیدن آنها افراط نکنیم. داروهای ضد درد و التهاب مانند بروفن، ناپروکسان و نیز داروهایی که برای کنترل فشار خون مصرف می شوند و ادرار را افزایش میدهند سطح لیتیم را بالا می برند
بهتر است برای کنترل سطح لیتیم خون هر سه ماه یکبار آزمایشات زیر و نیز سایر مواردیکه پزشک شما صلاح میداند انجام دهید
تیروئید
کلیه
سطح خونی لیتیم
روزانه 2 تا 3 لیتر از مایعات بنوشید
در صورت انجام ورزش های سنگین و یا سفر به نقاط سرد سیر و یا گرمسیر، پزشک خود را مطلع سازید
جاه های خالی جدول مندلیف
مندلیف حدود 3۰خانه از جدول را خالی گذاشت و 6۴عنصر کشف شده تا آن زمان را در جدول تناوبی خود جای داد. اما مجموع این عناصر با هم 9۴عنصر می شود. در صورتیکه تاکنون با احتساب عناصری که نیمه عمر بسیار کمی دارند، شمار عناصر شناخته شده به 116 رسیده است.اما نبوغ مندلیف به خاطر این بود که عناصر زیادی هم بودند که هنوز شناخته نشده بودند ومندلیف هم هیچ جایی برای آنها در نظر نگرفته بود، اما جدول طوری تنظیم شده بود که افزودن خانه های بعدی به جدول به راحتی امکان پذیر شد.مندلیف هنگام تنظیم جدول تناوبی خود بعضی از خانه ها را خالی گذاشت وادعا كرد این خانه های خالی متعلق به عناصری است كه هنوز كشف نشده است . او حتی خواص این عناصر را پیشگویی كرد مندلیف هنگام تنظیم جدول خود اصل تشابه (( خواص عنصر ها در یك گروه )) را بر اصل افزایش تدریجی جرم اتمی برتری داد ینعی اگر عنصر هایی كه بر اساس افزایش تدریجی جرم اتمی باید زیر هم در یك گروه قرار می گرفتند از لحاظ خواص شیمیایی با یكدیگر تفاوت داشتند مندلیف جای عنصر را در جدول خالی گذاشته و عنصر با جرم اتمی بیشتر را در گروهی قرار می داد كه خواص شیمیایی آن ها متشابه بود . همچنین در بعضی موارد مندلیف مجبور شد ، برای رعایت اصل تشابه خواص در یك گروه اصل افزایش تدریجی جرم اتمی را نادیده گرفته و اتم سبك تر را جلوتر از اتم سنگین تر قرار دهد . به عنوان مثال در جدول تناوبی عنصر كبالت (( با جرم اتمی بیشتر )) جلوتر از عنصر نیكل (( با جرم اتمی كمتر )) آمده بود و یا عنصر تلوریم (( با جرم اتمی بیشتر )) جلوتر از عنصر ید ((با جرم اتمی كمتر)) آمده بود. مندلیف این استثنا ها را به خطای اندازه گیری در محاسبه ی جرم اتمی عنصر ها نسبت داد. همچنین در زمان تنظیم جدول تناوبی مندلیف ، هنوز گازهای بی اث یا نادر شناخته نشده بود. از این رو، در متن جدول اصلی مندلیف نیز جایی برای آنها پیش بینی نشده بود. اما با توجه به نبوغ مندلیف در تنظیم جدول، این امر اشکالی به وجود نیاورده بود. به طوری که هنگامی که رامسی و رایلی در سال 1894 گاز آرگون را کشف کردند و تا سال 1908 گازهای بی اثر دیگر نیز کشف شد، ابتدا آنها را پیش از فلزهای قلیایی در ستون جداگانه ای به نام گروه صفر قرار دادند و بعد از کشف ساختار اتم و با توجه به آرایش الکترونی اتمها، آنها را به آخر جدول منتقل کردند. اما سه عنصر معروف که مندلیف جای و حتی خواص شیمیایی آنها را پیش بینی کرد، همان گالیم و اسکانیدم و ژرمانیم است که مندلیف آنها را به ترتیب اکا آلومینیم، اکابور و اکاسیلیسم نامیده بود.
خواص اتمی و فیزیکی هالوژن ها (1)
در این مطلب با گرایش های فیزیکی و اتمی مانند شعاع اتمی، الکترونگاتیوی، الکترون خواهی و دمای ذوب و جوش در فلوئور، کلر، برم و ید آشنا می شویم.
همچنین در ادامه با آنتالپی پیوند (قدرت) پیوندهای هالوژن – هالوژن و پیوندهای هیدروژن – هالوژن آشنا خواهیم شد.
 |
 |
 |
 |
تغییرات شعاع اتمی:
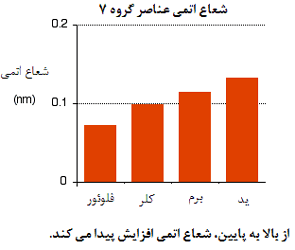
توضیح علت افزایش شعاع اتمی:
شعاع یک اتم توسط عامل های زیر کنترل می شود:
- تعداد لایه های الکترون های اطراف هسته
- کششی که الکترون های بیرونی تر از هسته احساس می کنند.
با مقایسه فلوئور و کلر، تعداد الکترون های هر لایه خواهد بود:

در هر مورد، الکترون های خارجی، کشش خالص +7 را از سوی هسته احساس می کنند. بار مثبت بر روی هسته توسط منفی بودن الکترون های داخلی کم می شود.
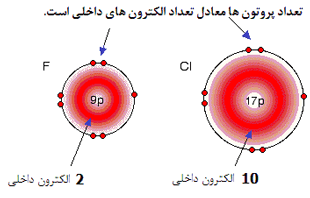
این روند برای تمام اتم های گروه 7 نیز صادق است.
بنابراین تنها عاملی که اندازه اتم را تحت تأثیر قرار می دهد، تعداد لایه های الکترون های داخلی است که باید در اطراف اتم جا بگیرند. بدیهی است که لایه های بیش تر الکترونی، جای بیش تری اشغال خواهد کرد (چون الکترون ها در این حالت، بیش تر همدیگر را دفع خواهند کرد). این به معنای آن است که با پایین رفتن در این گروه، اتم ها بزرگ تر شوند.
تغییرات الکترونگاتیوی:
الکترونگاتیوی، اندازه گیری تمایل یک اتم برای جذب جفت الکترون های پیوندی است. معمولا از مقیاس پالینگ برای اندازه گیری الکترونگاتیوی استفاده می شود که فلوئور، الکترونگاتیوترین عنصر جدول تناوبی است.
توجه کنید که با پایین رفتن در این گروه، الکترونگاتیوی کاهش پیدا می کند.
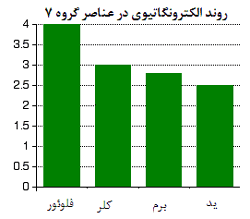
توضیح علت کاهش الکترونگاتیوی:
این علت به سادگی از شکل های فلوئورید هیدروژن و کلرید هیدروژن فهمیده می شود:
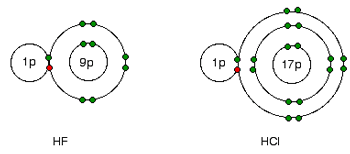
جفت های پیوندی الکترون ها بین هیدروژن و هالوژن، همان کشش خالص +7 را از هر دو اتم کلر و فلوئور احساس می کند. اما در مورد کلر، هسته دورتر از جفت پیوندی است. این به معنای آن است که کلر به شدت فلوئور، جذب نمی شود.

کشش بزرگ تر از هسته نزدیک تر فلوئور، دلیل الکترونگاتیوتر بودن فلوئور نسبت به کلر است.
همچنان که هالوژن ها بزرگ تر می شوند، هر جفت پیوندی از هسته هالوژن دورتر می شود؛ بنابراین با قدرت کم تری جذب هسته اتم می شود. به بیان دیگر از بالا به پایین، الکترونگاتیوی کم می شود.

تغییرات اولین الکترون خواهی:
اولین انرژی الکترون خواهی، انرژی آزاد شده ای است که 1 مول از اتم های گازی، یک الکترون به دست می آورد تا 1 مول از یون -1 تشکیل دهد:
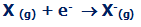
وقتی این تغییر اتفاق می افتد، انرژی اولین الکترون خواهی، انرژی آزاد شده در هر مول اتم X است.
این انرژی، مقدار منفی دارد. برای مثال، اولین الکترون خواهی کلر، -394 KJ/mol است. طبق قرارداد، علامت منفی نشان دهنده آزاد شدن انرژی است.
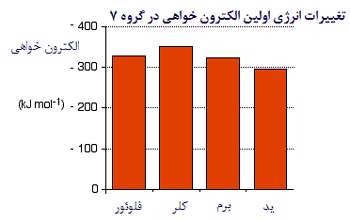
توجه کنید که روند تغییرات الکترون خواهی در گروه، منظم نیست. به استثنای فلوئور، مقادیر الکترون خواهی کم تر می شود (گرمای کم تری آزاد می شود).
الکترون خواهی، اندازه گیری جاذبه بین الکترون ورودی به یک اتم و هسته است.جاذبه بیش تر به معنای الکترون خواهی بیش تر است.
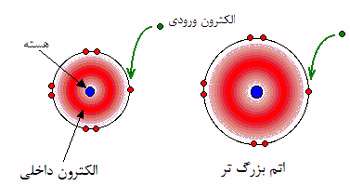
در اتم بزرگ تر، جاذبه از هسته ای با بار مثبت بیش تر، توسط الکترون های محافظ خنثی می شود؛ بنابراین هر الکترون ورودی، اثر بار خالص +7 را از مرکز اتم احساس می کند؛ دقیقا مثل حالت شعاع اتمی یا الکترونگاتیوی.
وقتی اتم، بزرگ تر می شود، الکترون ورودی از هسته دورتر می شود و جاذبه کم تری احساس می کند. پس مقدار الکترون خواهی در این گروه از بالا به پایین کاهش می یابد.
اما چرا فلوئور فرق دارد؟
فلوئور، اتم بسیار کوچکی است، پس الکترون ورودی به هسته فلوئور بسیار نزدیک است. پس چرا الکترون خواهی آن از کلر کم تر است؟
در این مورد، عامل دیگری نقش دارد. وقتی الکترون تازه ای به یک اتم اضافه می شود، وارد فضایی با بار منفی زیاد به دلیل الکترون های موجود می شود. بنابراین دافعه ناشی از این الکترون ها مقداری از جاذبه هسته را خنثی می کند.
چون اتم فلوئور بسیار کوچک است، چگالی الکترونی بسیار بالاست. این به معنای آن است که دافعه زیاد است و چاذبه هسته را آن قدر کم می کند که الکترون خواهی فلوئور کم تر از کلر باشد.
هلیم، پس از نئون، کم واکنش ترین گاز نجیب و البته دومین عنصر کم واکنش پذیر در میان همهٔ عنصرها است. این گاز کم واکنش، در همهٔ شرایط استاندارد به صورت تکاتمی باقی میماند. هلیم به دلیل داشتن جرم مولی نسبتا پایین، دارای رسانش گرمایی و ظرفیت گرمایی بالایی است و سرعت صدا هم در آن، در حالت گازی، از هر گاز دیگری به جز هیدروژن، بالاتر است. همچنین به دلیل همانند و به دلیل کوچکی اندازهٔ اتم هلیم، نرخ پخش در اجسام جامد، سه برابر بیشتر از نرخ پخش هوا و برابر با ۶۵٪ نرخ پخش هیدروژن است.
هلیم نسبت به دیگر گازهای تک اتمی از همه کمتر در آب حل میشود. و نسبت به دیگر گازها، می توان گفت یکی از کم حل شدنی ترین گازها است؛ ضریب حلالیت این گاز 0.70797 x۲/۱۰−۵ است که از CF۴ و SF۶ و C۴F۸ که به ترتیب دارای میزان حلالیتهای ۰٫۳۸۰۲ و ۰٫۴۳۹۴ و 0.2372 x۲/۱۰−۵اند، بیشتر است (مول). ضریب شکستهلیم بیش از هر گاز دیگری به یک نزدیک است. ضریب ژول-تامسونهلیم در دمای معمولی پیرامونش، منفی است به این معنی که اگر اجازه دهیم این گاز آزدانه افزایش حجم پیدا کند، گرم تر میشود. اما اگر هلیم در زیر دمای واژگون ژول-تامسون (در حدود ۳۲ تا ۵۰ کلوین در یک اتمسفر) باشد، اگر اجازه داشته باشد آزادانه افزایش حجم پیدا کند، دمای آن پایین میآید. با توجه به این ویژگی اگر دمای هلیم از این دما پایین تر آماده باشد، می توان با افزایش حجم، آن را خنک و مایع کرد.
برخلاف دیگر عنصرها در فشار معمولی، هلیم تا دمای صفر مطلق، همچنان مایع باقی میماند. دلیل این پدیده را می توان با مکانیک کوانتوم توضیح داد: بویژه انرژی نقطهٔ صفر این سامانه بسیار بالا است برای اینکه بخواهد اجازه دهد هلیم جامد شود. هلیم برای جامد شدن باید به دمایی میان ۱ تا ۱٫۵ کلوین (۴۵۷- فارنهایت یا ۲۷۲- سلسیوس) و فشاری نزدیک به ۲٫۵ مگاپاسکال برسد. معمولا شناسایی هلیم جامد از مایع کمی دشوار است چون ضریب شکست هر دو بسیار نزدیک است. هلیم در حالت جامد دارای نقطهٔ ذوب دقیق است، ساختار بلوری دارد و بسیار تراکم پذیر است تا حدی که با وارد کردن فشار بر آن می توان تا بیش از ۳۰ درصد حجم آن را کاهش داد. ضریب کشسانی حجمی آن نزدیک به ۲۷ مگاپاسکال است که تقریبا ۱۰۰ برابر بیشتر از آب تراکم پذیر است. چگالی هلیم جامد در دمای ۱٫۱ کلوین و فشار ۶۶ اتمسفر، ۰٫۲۱۴ ± ۰٫۰۰۶ g/cm۳ و در دمای صفر کلوین و فشار ۲۵ بار (۲٫۵ مگاپاسکال)، ۰٫۱۸۷ ± ۰٫۰۰۹ g/cm۳ است.
هلیم دارای ویژگیهاییکتایی است که در بسیاری جاها به آن نیاز است. این ویژگیهایهلیم عبارتند از: نقطهٔجوش، چگالی و حل شوندگی پایین، رسانش گرمایی بالا و واکنش ناپذیر بودن آن. از سال ۲۰۰۸ میزان تولید هلیم، ۳۲ میلیون کیلوگرم یا ۱۹۳ میلیون مترمکعب در سال بودهاست که بیشترین کاربرد آن (نزدیک به ۲۲ درصد کل در سال ۲۰۰۸) در کاربردهای سردکننده بویژه در آهنربایابررسانا در دستگاههایامآرآی است. دیگر کاربردهای مهم آن (۷۸ درصد کل در سال ۱۹۹۶) برای ایجاد فشار، هوای پیرامونی کنترل شده و جوشکاریبودهاست.
هلیم، در فرایند جوشکاری با قوس الکتریکی بر روی موادی که در دمای جوشکاری در اثر تماس با هوا یا نیتروژن دچار آسیب میشوند به عنوان لایهٔ محافظ یا پوشش عمل میکند. گازهای گوناگونی در جوشکاری با قوس الکتریکی به عنوان گاز محافظ به کار میروند که هلیم به جای آرگون ارزان، بویژه برای موادی که رسانش گرمایی بالاتری دارند مانند آلومینیم و مس بکار میرود.
هلیم طبیعی در شرایط استاندارد، آسیب رسان نیست. اندازههای بسیار اندکی از این ماده در خون انسان پیدا میشود. اگر بجای اکسیژن مورد نیاز بدن، هلیم را تنفس کنیم امکان خفگی پیش میآید. نکتههای ایمنی گفته شده دربارهٔهلیم مایع و کار با آن همانند کار با دیگر نیتروژن مایع است. چون دمای آن بسیار پایین است و ممکن است فرد دچار سوختگی در اثر سرما شود.
سرعت صدا در هلیم نزدیک به سه برابر بیشتر از سرعت آن در هوا است. چون بسامد پایه در گاز با سرعت صدا در گاز متناسب است. هنگامی که هلیم را تنفس میکنیم در بسامد تولیدی توسط مجرای صوتی، تشدید رخ میدهد و کیفیت صدا را تغییر میدهد. برعکس این اثر و رسیدن به بسامدهای پایین تر هم ممکن است به شرطی که گازهای سنگین تر مانند هگزا فلوراید گوگرد یا زنون را تنفس کنیم.
تنفس هلیممیتواند خطرناک باشد چون این گاز میتواند خود را جایگزین اکسیژن مورد نیاز در تنفس معمولی کند. تنفس هلیم به تنهایی هم باعث خفگی در چند دقیقه میشود. از این ویژگی در طراحی کیفهای خودکشی بهره برده میشود.
تنفس هلیمی که در کپسول فشرده شده بسیار خطرناک است چون شدت جریان آن بالا است و میتواند باعث فشارزدگی گوش میانی و پارگی ناگهانی ششها شود. البته شمار مرگ به خاطر پارگی ششها بسیار کم بودهاست برای نمونه از سال ۲۰۰۰ تا ۲۰۰۴ تنها دو مورد مرگ در آمریکا گزارش شدهاست. در سال ۲۰۱۰ هم دو مورد مرگ گزارش شدهاست که یکی در آمریکاو دیگری در ایرلند شمالی رخ داده بود
در فشارهای بالا (بیش از ۲۰ اتمسفر یا ۲ مگاپاسکال) آمیختهای از هلیم و اکسیژن (هلیوکس) میتواند باعث مشکل در دستگاه عصبی شود (سندرم اعصاب در فشار بالا) که با افزودن مقدار اندکی نیتروژن به این آمیخته می توان مشکل را کاهش داد.
یک کاربرد صنعتی هلیم، تشخیص جای نشت است. چون هلیم توان پخش شدن خوبی از میانهٔبدنهٔ جامد دارد، سه بار تندتر از هوا، برای همین به عنوان گازی که میتواند محل نشت را ردیابی کند، بکار میرود. برای نمونه می توان از مخزنهای فشارهای بالا یا ابزارهای سردکننده یاد کرد. برای تشخیص جای نشت یک ابزار، آن را درون یک محفظه که اول کاملا تهی شده و سپس از هلیم پر شده، میگذارند. هلیمی که از محلهای نشت رد شده را با کمک ابزار طیف سنجی جرمی هلیم شناسایی میکنند. این ابزار بسیار دقیق است و دقت آن به ۱۰−۹mbar•L/s یا ۱۰−۱۰ Pa•m3/s هم میرسد. این فرایند اندازه گیری معمولا به صورت خودکار انجام میشود و در اصطلاح به آن helium integral test می گویند. یک فرایند ساده تر شناسایی نشت، پر کردن وسیلهٔ مورد نظر از هلیم است برای این کار پس از پر کردن، باید با ابزارهای دستی محل نشت را جستجو کرد.
هلیمی که از ترکهای یک وسیله میگذرد را نباید با نفوذ گاز از بدنهٔ ماده اشتباه گرفت. ثابت نفوذ هلیم از بدنهٔ مواد (شیشه، سرامیک و مواد آزمایشگاهی)، مشخص است و ضریب گذر آن قابل محاسبهاست. البته بیشتر گازهای بی اثر مانند گازهای نجیب و نیتروژن و البته هلیم، از بدنهٔ بیشتر مواد نمیتوانند بگذرند.
چون هلیم از هوا سبکتر است (نزدیک به ۷ درصد شناوری بیشتری دارد)، برای به هوا رفتن کشتیهای هوایی و بالونها به گاز هلیم رو آوردهاند. همچنین ویژگیهایی چون آتشگیر نبودن و به تاخیر انداختن آتش باعث سازگاری بیشتری هلیم برای این کاربردند. با اینکه کاربرد هلیم در بالونها بسیار شناختهاست اما این مطلب تنها بخش کوچکی از کاربردهای این گاز است. کاربرد دیگر هلیم در موشکهایفضاپیما است. فضای خالی بالای جایی که سوخت قرار دارد را از هلیم پر میکنند؛ این کار باعث میشود تا هم جابجایی سوخت و اکسیدکنندهها آسان تر شود و هم بتوان با آن هیدروژن و اکسیژن را فشرده کرد تا سوخت موشک بدست آید. همچنین برای زدودن سوخت و اکسیدکنندهها از ابزارهای پیش از پرواز و پیش خنک کردن هیدروژن مایع در فضاپیما به آن نیاز است. برای نمونه موشک ساترن ۵ در برنامهٔ فضایی آپولو پیش از پرتاب به 370,000 m۳هلیم نیاز داشت.
تا کنون ۸ ایزوتوپ برای هلیم پیدا شدهاست. که از میان آنها هلیم-۳ و هلیم-۴ تنها ایزوتوپهای پایدار آن اند. در هواکرهٔ زمین در برابر هر یک اتم هلیم-۳ یک میلیون هلیم-۴ وجود دارد. برخلاف بیشتر عنصرها، فراوانی ایزوتوپهایهلیم بسته به منبع تولید و فرایند پدیداری شان بسیار متفاوت است. فراوان ترین ایزوتوپ آن، هلیم-۴ در زمین از راه واپاشیآلفای عنصرهای پرتوزای سنگین تر تولید میشود. پرتوهایآلفای تابیده شده همگی هستههاییونیزهشدهٔ هلیم-۴ اند. هلیم-۴ به طرز غیرمعمولیهستهٔ پایداری دارد چون ذرههایهستهای آن از آرایش الکترونی پایداری برخوردازند. این ایزوتوپها در جریان هستهزاییمهبانگ به فراوانی تولید شدند.
هلیم دومین عنصر سبک جهان است و از دید فراوانی در جایگاه دوم است. نزدیک به ۲۴٪ از جرم گیتی از آن این عنصر است که این مقدار بیش از ۱۲ برابر ترکیب تمام عنصرهای سنگین است. هلیم به همان صورت که در خورشید و هرمز یافت میشود در جهان پیدا میشود و این به دلیل انرژی بستگی (به ازای هر هسته) بسیار بالای هلیم-۴ نسبت به سه عنصر دیگر پس از آن در جدول تناوبی است. بیشتر هلیم موجود در گیتی، هلیم-۴ است و گمان آن میرود که در جریان مه بانگ پدید آمده باشد. امروزه با کمک واکنشهایهمجوشیهستهای در ستارهها، گونههای تازهای از هلیم ساخته شدهاست.
معرفی : لانتانیدها عنصرهای 58 تا 71جدول تناوبی را تشکیل میدهند و جزو عناصر واسطه داخلی میباشند. وجه تسمیه لانتانیدها از عنصر 57 جدول یعنی لانتان(La) گرفته شده است. باید توجه داشت که خواص شیمیایی این دسته از عناصر مشابه خواص لانتان میباشد همچنین به این گروه از عناصر ، عناصر خاکهای کمیاب "Rare-earth elements"نیز اطلاق میشود. در واقع اطلاق نام خاکهای نادر یا کمیاب ، از آنجائیکه این عناصر نه کمیابند و نه به آن دسته از اکسیدهای خاکی مانند (اکسیدهای) آلومینا، زیرکونیا و ایتریا تعلق دارند، غلط مصطلح است. زمانیکه نخستین اعضای این گروه برای اولین بار کشف شد، بصورت اکسید مجتمع گردیده بودند و از آنجائیکه این اکسیدها تا اندازهای به اکسیدهای کلسیم ، منیزیم و آلومینیوم که بعدها به آنها عنوان اکسیدهای خاکی اطلاق گردید، شباهت دارند، لذا این عناصر به نام خاکهای کمیاب معروف گردیدند. در هر صورت باید توجه داشت که سریم در پوسته زمین بسیار فراوان تر از سرب بوده و نیز ایتریم از قلع بسیار فراوانتر است و حتی باید اذعان نمود که کمیاب ترین خاکهای کمیاب ، به استثنای پرومتیم ، بسیار از عناصر گروه پلاتین فراوانترند.
معرفی : لانتانیدها عنصرهای 58 تا 71جدول تناوبی را تشکیل میدهند و جزو عناصر واسطه داخلی میباشند. وجه تسمیه لانتانیدها از عنصر 57 جدول یعنی لانتان(La) گرفته شده است. باید توجه داشت که خواص شیمیایی این دسته از عناصر مشابه خواص لانتان میباشد همچنین به این گروه از عناصر ، عناصر خاکهای کمیاب "Rare-earth elements"نیز اطلاق میشود. در واقع اطلاق نام خاکهای نادر یا کمیاب ، از آنجائیکه این عناصر نه کمیابند و نه به آن دسته از اکسیدهای خاکی مانند (اکسیدهای) آلومینا، زیرکونیا و ایتریا تعلق دارند، غلط مصطلح است. زمانیکه نخستین اعضای این گروه برای اولین بار کشف شد، بصورت اکسید مجتمع گردیده بودند و از آنجائیکه این اکسیدها تا اندازهای به اکسیدهای کلسیم ، منیزیم و آلومینیوم که بعدها به آنها عنوان اکسیدهای خاکی اطلاق گردید، شباهت دارند، لذا این عناصر به نام خاکهای کمیاب معروف گردیدند. در هر صورت باید توجه داشت که سریم در پوسته زمین بسیار فراوان تر از سرب بوده و نیز ایتریم از قلع بسیار فراوانتر است و حتی باید اذعان نمود که کمیاب ترین خاکهای کمیاب ، به استثنای پرومتیم ، بسیار از عناصر گروه پلاتین فراوانترند.
اگرچه لانتانیدها بصورت بسیار گسترده در طبیعت پخش میباشند، لکن بطور کلی در غلظتهای کم یافت میشوند. همچنین در برخی از مواد کانی بصورت مخلوط و در غلظتهای زیاد ملاحظه شده اند. جدول زیر نمایانگر برخی از کانیهای معروف لانتانیدها میباشد.
|
ماده کانی
|
شکل بلور
|
ترکیب فرمولی
|
| مونازیت (monazite) |
تک شیب
|
CePO4 با Th3(PO4)4
|
| زنوتیم (xenotime) |
چهارگوش
|
YPO4
|
| گادولینیت (gadolinite) |
تک شیب
|
2BeO.FeO.Y2O3.2SiO2
|
| بستناسیت (bastnasite) |
ششگوش
|
CeFCO3
|
| سامارسکیت (samarskite) |
مکعب مستطیل
|
Ca٫Fe٫UO2)3O.Y2O3.3(Nb٫Ta)2O5)
|
| فرگوزونیت (fergusonite) |
چهارگوش
|
Y2O3.3(Nb٫Ta)2O5
|
| اوکسنیت (euxenite) |
مکعب مستطیل
|
Y2(NbO3)3.Y2(TiO3)3.1½H2O
|
| ایتروفلوئوریت (yttrofluorite) |
مکعب
|
2YF3.3CaF3
|
مهمترین کانیهای خاکهای کمیاب عبارتند از:مونازیت ، زنوتیم ، بستناسیت. معمولا این مواد بوسیله اعمال مکانیکی مانند شناورسازی و یا استفاده از روشهای مغناطیسی تغلیظ میشوند. سپس لانتانیدها در حالتیکه بصورت کانیهای فسفات یا سیلیکات میباشند، بوسیله اسید مورد شستشو قرار میگیرند. برخی از کانیها مانند کولومبوتانتالاتها با کربن حرارت داده شده و یا تحت تاثیر کاستیک قوی قبل از سنگ شویی قرار داده میشوند.
تجزیه و جداسازی
لانتانیدهای مخلوط شده را میتوان از محلولهای اسیدی با استفاده از رسوب اگزالات جدا کرد. اشتعال اگزالات باعث تولید اکسیدهای لانتانیدهای مخلوط خواهد گردید. سپس این اکسیدها غالبا با استفاده از روشهای تبادل یونی و استفاده از خیساندن در اسید تغلیظ میشوند. در این حال لانتانیدها در محلول بصورت یونهای سه ظرفیتی هیدراته که دارای خواص بسیار مشابه میباشند، درمیآیند. بنابراین آنها تمایل به تشکیل رسوبهای بلوری مخلوط یا محلولهای جامد نشان میدهند. استفاده از یک ماده شیمیایی واحد به منظور افزایش غلظت یکی از عناصر خاکهای کمیاب لزوم تکرار عملیات را ایجاب مینماید. یکی از روشهایی که در گذشته و حال مورد استفاده بوده و هست، استفاده از فرایندهای جزء به جزء مانند تبلور جزء به جزء و یا تجزیه جزء به جزء به منظور خالص کردن عناصر می باشد. در این شرایط ، مقدار کار بسیار زیاد به منظور جداکردن مقدار بسیار کمی از عناصر ، باعث بالارفتن هزینه های خلوص خاکهای کمیاب و برشمردن آنها بدین صنعت خواهد بود. اکنون نیز از روشهای جزء به جزء هنوز در زمینه جداسازی این خاکها در حالت خام و بویژه عناصر لانتان و سریم استفاده میشود، زیرا سریم را می توان از لانتان با استفاده از حالت چهار ظرفیتی سریم جدا کرد. در حال حاضر سایر اعضای خانواده خاکهای کمیاب را با استفاده از فرآیندهایی تبادل یونی خالص می نمایند مضافا چنانچه درجه خلوص بالا مدنظر نباشد، می توان از روش استخراج مایع- مایع بدین منظور استفاده کرد.
خواص لانتانیدها
لانتانیدها فلزهایی براق هستند و واکنش پذیری شیمیایی قابل توجهی دارند. خواص شیمیایی این دسته از عناصر مشابه خواص لانتان با عدد اتمی 57 می باشد. کلیه این عناصر قادر به تشکیل املاح سه ظرفیتی می باشند و زمانیکه این املاح در آب حل می شوند، خواص شیمیایی بسیار مشابه از خود نشان می دهند. لانتانیدها ، نظر به وضعیت جدو!ل تناوبی، بدین صورت هستند که همچنانکه عدد اتمی آنها افزوده می شود، بار افزوده شده روی هسته آنها بوسیله پر شدن لایه های ناقص داخلی آنها با الکترونها ، موازنه میشود. ولی به هر حال باید توجه داشت که این لایه ها نقشی در نیروهای والانس ما بین اتمها ایفا نمی نمایند. لانتانیدها به علت برخوردار بودن از خواص اختصاصی دارای پتانسیل باارزشی در زمینه استفاده بعنوان عوامل آلیاژی میباشند. این عناصر با استفاده از احیاء گرمایی بوسیله اثر کلسیم ، لیتیم و یا سایر فلزات قلیایی برهالید بی آب آنها و سپس ذوب مجدد در خلا به منظور تبخیر نشانه های باقیمانده از مواد احیا کننده، احیا می شوند. همچنین میتوان آنها را بصورت الکترولیتی از حمامهای ملح ذوب شده مانند آنچه در زمینه سریم و میش متال (مخلوط فلزات خاکهای کمیاب ، اساسا سریع با مقدار بسیار کمی از آهن) صورت می پذیرد، احیا کرد. باید توجه داشت که مواد جامد بدون آب همچنین نشان دهنده تغییر زیادتری در خواص ما بین عناصر نسبت به املاح هیدراته هستند. خاکهای کمیاب با بعضی از ترکیبات آلی ، املاح آلی تشکیل میدهد. این کیلیت ها که در اطراف این یونها ، آب جایگزین می نمایند، باعث زیاد شدن تغییر در خواص ما بین هر یک از خاکهای کمیاب میشوند. سودمندی این تکنیک در روشهای جدید تبادل یونی ، در زمینه جداسازی این عناصر کاملا قابل ملاحظه است.
موارد کاربرد
- فلزات خاکهای کمیاب تمایل بسیار شدید برای ترکیب با ناخالصیهای غیر فلزی مانند اکسیژن ، نیتروژن ، کربن و هیدروژن دارند. لذا با توجه به خاصیت فوق ، مقدار قابل ملاحظه ای از مخلوط فلزات خاکهای کمیاب بعنوان مواد تصفیه کننده (getler) در صنایع متالوژی مورد استفاده واقع می شود.
- عناصر خاکهای کمیاب ، هنگامیکه تحت تاثیر حرارت واقع می گردند نمایانگر طیف بسیار پیچیده ای بوده و نور شدید سفید زدگی از آنها ساطع می شود، بنابراین از آنها در صنایع تصاویر متحرک و لامپ های تصویر تلویزیون های رنگی استفاده می گردد.
- مصارف صنعتی فراوانی نیز برای هر یک از این عناصر متصور می باشد از جمله از برخی از آنها در سوزاندن سموم ناشی از راکتورهای هسته ای استفاده می شود.
هیدروژن ساده ترین عنصر شناخته شده برای انسان است؛ هر اتم هیدروژن تنها یك پروتون و یك نوترون دارد. هیدروژن فراوانترین گاز هستی است. ستاره ها در ابتدا از هیدروژن ساخته شده بودند. انرژی خورشید از هیدروژن به دست می آید. هیدروژن توپ عظیمی از گازهای هیدروژن و هلیوم است. درون خورشید، اتمهای هیدروژن تركیب می شود و اتمهای هلیوم را پدید می آورد. این پدیده گدازه « Pusiun » انرژی پرتوهای خورشید را تولید می كند. انرژی پرتوی خورشید باعث برقراری حیات روی
زمین است. این انرژی به ما نور می دهد، باعث رشد گیاهان می شود، بادها را به جریان می اندازد، باعث بارش باران می شود. این انرژی در سوختهای فسیلی ذخیره شده است. بیشتر انرژی مصرفی ما در حال حاضر از خورشید منشأ می گیرد. هیدروزن گازی (H2) روی زمین وجود ندارد. این عنصر همیشه به صورت تركیبی است. به طور مثال، تركیب با اكسیژن (H2O - آب) تركیب هیدروژن با كربن تركیبات شیمیایی متفاوتی مانند متان (CH4) و زغال و نفت را به دست می دهد . همچنین، هیدروژن در تراكم زیست و مواد عالی یافت می شود. هیدروژن از نظر امروزی بیشترین محتوای انرژی هر سوخت را دارد؛ اما از نظر حجمی، كمترین فشار عادی به صورت گاز وجود دارد. هیدروژن می تواند انرژی را ذخیره كند. بیشتر انرژی كه ما امروزه مصرف می كنیم از سوختهای فسیلی به دست می آید. تنها 6% منابع انرژی از منابع تجدیدپذیرند؛ زیرا این انرژیها تمیزتر و مناسب استفاده تر در طول یك زمان كوتاه اند. منابع انرژی تجدیدپذیر مانند خورشید و باد نمی توانند همه وقت انرژی تولید كند. خورشید همیشه نمی تابد و باد همیشه نمی وزد. منابع تجدیدپذیر در زمان و مكانی كه ما نیاز داریم انرژی تولید نمی كند. ما نمی توانیم منابع انرژی زیادی برای تولید هیدروژن استفاده كنیم؛ هیدروژن می تواند انرژی را در زمان و مكانی كه ما نیاز داریم تأمین کنید. هیدروژن انتقال دهنده انرژی: هر روز ما انرژی برقی بیشتری مصرف می كنیم. برق منبع ثانویه انرژی است؛ منابع ثانویه انرژی كه گاهی به آنها ناقلهای انرژی هم گفته می شود انرژی را به مصرف كننده می رساند. از آنجا كه استفاده و انتقال برق برای ما آسانتر است، ما انرژیها را به انرژی برق تبدیل می كنیم. برق به ما نور، گرما، آب داغ، غذای سرد، تلویزیون، رایانه می دهد. زندگی بسیار سخت می شد، اگر ما مجبور بودیم زغال بسوزانیم، اتم بشكافیم، یا سدهای خود رابسازیم؛ پس انرژی زندگی را ساده تر كرده است. هیدروژن ناقل انرژی برای آینده است. این عنصر سوخت تمیزی است كه می توان آن را در جاهایی جایگزین کرد كه ما بسختی از برق استفاده می كنیم. فرستادن برق در مسیرهایی طولانی 4 برابر بیشتر از حمل دریایی هیدروژن به صورت خطوط لوله ای هزینه دارد. هیدروژن چطور ساخته می شود؟ از آنجا كه هیدروژن گازی در زمین وجود ندارد، ما باید آن را بسازیم. با جدا كردن هیدروژن از آب، تراكم زیست یا گاز طبیعی از منابع محلی هیدروژن می سازیم. دانشمندان حتی كشف كرده اند كه بعضی جلبكها و باكتریها هیدروژن تولید می كنند. تولید هیدروژن در حال حاضر بسیار گران است؛ اما فنون جدیدی برای این كار در حال توسعه است. هیدروژن را می توان برای خدمات رفاهی مركزی بزرگ یا دستگاههای كوچك با كاربرد محلی تولید کرد. از این رو، انعطاف پذیری هیدروژن یكی از امتیازات عمده آن است . كاربردهای هیدروژن: هیدروژن در صنعت به مصرف پالایش و پرداخت فلزات و فراوری غذاها می رسد.NASA اولین كاربر هیدروژن به عنوان ناقل انرژی است كه هیدروژن را برای سالها در برنامه فضایی مورد استفاده قرار داد. تنها محصول فرعی در چنین فرایندهایی آب است كه خدمه موشك از آن برای نوشیدن استفاده می كند. سلولهای سوختی هیدروژن یا باتریهای هیدروژنی برق تولید می كند. آنها كارایی بسیاری دارند، اما ساخت آنها گران است. سلولهای سوختی كوچك می توانند برق مناطق دوردست را تأمین كند. هیدروژن به عنوان سوخت: دستگاههای نیروی هیدروژنی برای مدتی ساخته نخواهند شد؛ زیرا هزینه زیادی به همراه دارد. هیدروژن ممكن است بزودی به گاز طبیعی اضافه شود تا از آلودگی دستگاههای موجود بكاهد. هیدروژن بزودی به گازوئیل اضافه خواهد شد تا آلودگی را كاهش دهد و كارایی را زیاد كند. اضافه كردن تنها 5% هیدروژن به گازوئیل ممکن است به میزان درخور توجهی اكسید نیتروژن را (كه در آلودگی لایه اوزن بسیار مؤثر است) كاهش دهد. موتوری كه هیدروژن خالص می سوزاند تقریباً هیچ آلودگی ندارد. شاید حدود 10 تا 20 سال به استفاده از خودرو شخصی مصرف كننده هیدروژن باقی مانده است. آینده هیدروژن: قبل از اینكه هیدروژن به عنوان سوختی مهم شناخته شود، باید سامانه های جدید زیادی ساخت. ما به سامانه هایی نیاز خواهیم داشت كه هیدروژن بسازند ذخیره كنتور انتقال دهند. ما به خطوط لوله و سلول سوختی اقتصادی نیاز خواهیم داشت و مصرف كنندگان به فناوری و آموزش استفاده از آن نیاز خواهند داشت
شعاع اتمی و یونی
همانطورکه میدانید/بیشتر فضای اتم خالی است.در واقع الکترون هادر محدوده هایی حرکت میکنند که شبیه به ابر به نظر میرسند.
بااین تشبیه می توان تصور کرد که تا چه اندازه/اندازه گیریابعاداتم ها دشوار است/زیرا مرزهای یک توده ابر مانند/نامشخص ومتغیر است.اندازه یک اتم به وسیله شعاع آن تعیین میشود.شعاع کووالانسی و واندروالسی دو نوع شعاع اتمی هستند.روش های تعیین شعاع اتمی عبارت اند از:
شعاع کووالانسی{Rc }
به نصف فاصله بین هسته ای دو اتم مشابه در یک مولکول دو اتمی هم نام/شعاع کووالانسی می گویند.واحد شعاع کووالانسی pm است.{pm=10m1}
در مولکول های تک اتمی مانند گازهای نجیب که اتم ها با یکدیگر پیوند کووالانسی نمی دهند/برای تعیین شعاع اتمی به جای شعاع کووالانسیباید شعاع واندر واندروالسی را اندازه گیری نمود.
شعاع واندروالسی{Rw}
به نصف فاصله بین هسته ای دو اتم مجاور مشابه از دو مولکول مجاور/شعاع واندروالسی میگویند.واحد شعاع واندروالسی pm است.{pm=101}
در مورد یک عنصر/همواره شعاع واندروالسی بزرگتر از شعاع کووالانسی است.
روند تغییر شعاع اتمی در یک گروه:
شعاع اتمی عنصر ها در هر گروه از جدول تناوبی از بالا به پایین به دو دلیل/افزایش میابد:
*از بالا به پایین در یک گروه جدول /به ازای هر تناوب یک لایه الکترونی جدید به تعداد لایه های الکترونی عنصر ها افزوده میشود.با زیاد شدن تعداد لایه های الکترونی/شعاع اتمی نیز افزایش میابد.به عبارت دیگر الکترون ها در فاصله دورتری نسبت به هسته قرار می گیرند.
*دلیل دیگر برای افزایش شعاع اتمی این است که با افزایش عدد اتمی در یک گروه/تعداد اربیتال های پرشده بین هسته و لایه های الکترونی بیرونی اتم افزایش میابد.وجود الکترون ها در اربیتال های درونی و اثرپوششی آنها بر الکترون های بیرونی/باعث افزایش فاصله الکترون های بیرونی از هسته یا به عبارتی افزایش شعاع اتمی میشود.
*بسیاری از دانش آموزان به اشتباه فکر می کنند که دلیل افزایش شعاع اتمی در یک گروه از بالا به پایین/کاهش بار موثر هسته برالکترون های ظرفیت است.ولی همانطور که در مبحث مربوط به بار{بار موثر هسته} گفته شد/در یک گروه از بالا به پایین/بار موثر هسته افزایش میابد.
توجه داشته باشید که در اعیین فاصله الکترون های بیرونی از هسته اتم و به عبارت دیگر شعاع اتمی/علاوه بر بار موثر هسته/میزان دافعه الکترون های بیرونی با الکترون های درونی نیز تاثیر دارد.به طورکلی می توان گفت مهم ترین عامل در افزایش شعاع اتمی در یک گروه از بالا به پایین/افزایش تعداد لایه های اصلی الکترونی است.
چگونگی ساخته شدن اولین جدول تناوبی
از چند قرن پیش که کم کم بشر عناصر را شناخت و تعداد عناصر شناسایی شده افزایش یافت نیاز به طبقه بندی آنها احساس گردید به طوری که در ابتدا عناصر را به دو دسته فلزات و نافلزات
تقسیم بندی نمودند و بعد بر اساس ترکیباتی که تشکیل می دادند آنها را تقسیم بندی کردند. دانشمندان زیادی در دو قرن اخیر جدول های طبقه بندب عنصرها را به شکل های مختلف ارائه
داده اند اما در بین آنها کار دانشمندی روسی به نام دیمتری مندلیف اعتبار و شهرت زیادی پیدا کرده طوری که هم اکنون نیز جدول تناوبی اصلاح شده ی مندلیف در کتب درسی مورد مطالعه
قرار می گیرد
مندلیف چگونه جدول تناوبی عنصرها را تنظیم کرد؟
در سال 1869 که دیمیتری مندلیف روی طبقه بندی بهتر عنصرها تحقیق می کرد فقط ۶۳عنصر شناخته شده بود او ۶۳ کارت تهیه
کرد و روی هر کارت علاوه بر نام عنصر برخی خواص شناخته شده ی آن عنصر را نوشت مثل دمای ذوب و جوش و جرم اتمی
و ... بعد این کارت ها را به ترتیب افزایش ویژگی های مختلف کنار هم قرار میداد مثلا یکبار به ترتیب افزایش دمای ذوب و بار
دیگر به تریب افزایش ویژگی دیگر . وقتی مندلیف عنصرها را به ترتیب افزایش جرم اتمی کنار هم به صورت یک ردیف ۶۳ تایی چید به نکته جالبی بر خورد او دید که ویژگی های نوشته شده روی کارت ها ۸ تا ۸ تا تکرار می شود یعنی ویژگی های روی کارت اول مشابه کارت نهم و هفدهم و ... و کارت دوم مشابه کارت دهم و هجدهم و ...
است. کار جالبی که مندلیف انجام داد این بود که ضمن رعایت افزایش تدریجی جرم اتمی عنصرها کارت هایی که ویژگی های مشابهب داشتند را زیر هم در یک ستون قرار داد تا چیزی شبیه یک جدول درست شود به نحوی که عنصرها به ترتیب افزایش جرم اتمی کنار هم قرار گرفته اند و عنصرهای یک ستون نیز خواص مشابهی دارند. این اساس کار مندلیف برای تنظیم جدول تناوبی بود. در جدول تناوبی مندلیف فقط ۶۳ عنصر قرار داشت بنابراین بدیهی است که انتظار داشته باشیم برخی از جاهای جدول او نسبت به جدول امروزی خالی باشد در واقع مندلیف برای نظم دادن به جدول خود مجبور بود برخی از خانه های جدول را خالی نگه دارد تا عنصر هاي مشايه زير هم قرار گيرند او تصور مي كرد اين جاهاي خالي مربوط به عنصرهايي است كه هنوز كشف نشده اند و حتي توانست براي آنها برخي خواصشان را پيش بيني كند چون بايد خواصي بينابين عنصر بالاتر و پایین تر از خود در یک ستون داشته باشد.او همچنین از روی این جدول توانست وجود بعضی از عناصر را که تا آنروز کشف نشده بود حدس بزند و همين امر و پيش بيني هاي او كه درست از آب در مي آمد سبب شهرت زياد او نسبت به ساير دانشمندان هم دوره اش گرديد
واژه خاكي از نظر تاريخي براي بيان اين مطلب بوده است كه بسياري از تركيبهاي اين عنصرها در آب انحلال پذيرند.
چند مورد از كاربردهاي و ويژگي هاي منيزيم از اين قرار است:
منيزيم به طور گسترده به صورت كربنات و دولوميت و همچنين به صورت سيليكات در كانيهايي چون ازبست (يعني پنبه سوز) در آب دريا وجود دارد. منيزيم از آب دريا بدست ميايد. يون منيزيم به ميزان31/. درصد در آب دريا وجود دارد. اين يون را ابتدا توسط آب آهك بصورت منيزيم هيدروكسيد رسوب مي دهندوبعد آن را در هيدروكلريك اسيد حل مي كنند. از تغليظ محلول اخيرنمك منيزيم متبلور مي شود. از الكتروليز مذاب اين دولوميت كلسينه شده با آلياژ آهن -سيليسيم در دماي 1150 مي باشد. منيزيم با آب سرد واكنش نمي دهدولي بااب گرم واكنش مي دهد . آلياژچرخ هاي اتومبيل هاي مسابقات اتومبيل راني تركيبي است از آلياژفلزهاي منيزيم و آلومينيم و علت آن هم سبك بودن و محكم بودن و مقاوم بودن اين آلياژ است. اگر سطح فلز منيزيم درمجاورت هوا قرار گيرداين فلز با اكسيژن وارد واكنش شده و منيزيم اكسيدتشكيل مي شود . فلز منيزيم ازجمله فلز هاي سبك ومقاوم است و به اين دليل از آلياژهاي آن با آلومينيم در ساخت بدنه هواپيماها و موشك ها استفاده مي شود.منيزيم در مجاورت شعله با نور خيره كننده اي مي سوزد و به همين دليل در تهييه ي فشفشه ها و مواد آتش بازي كاربرد دارد و همچنين از گرد يا نوار آن در عكاسي به عنوان منبع نور شديداستفاده مي شود. امّا فلزّات قلیایی خاکی چه خصوصیاتی دارند؟ این گروه شامل: بریلیم(Be),منیزیم(Mg),کلسیم(Ca),استرانسیم(Sr),باریم(Ba),رادیم(Ra)می باشد.آرایش الکترونی تمام عناصر این گروه به nsختم میشود.در این گروه فلزّاتی قرار دارند که نسبت به گروه اوّل سخت تر وچگال تر و نقطه ذوب بالاتری دارند امّا واکنش پذیری کمتری دارند. حال می خواهم در موردخواص یکی از این عناصر به نام باریم به تفصیل توضیح دهم. باریم مشخصات فيزيکی و مکانيکی باريم اكسيد باريم، Baryta نام دارد و به صورت اوليه در كاني باريت BaSO4 يافت مي شود اما هرگز به شكل خالص ديده نمي شود، زيرا باريم در هوا بسيار واكنش پذير مي باشد. باريت (Barite & Baryte) يا سولفات باريم طبيعي BaSO4 از واژه يوناني) (Barus & Barys به معني سنگين يا چگال گرفته شده است(به اين کاني Heavy spar و گاهي Tiff نيز مي گويند). باريم چهاردهمين عنصر فراوان در پوسته زمين است که در حدود 050/0% پوسته زمين و 425 گرم در تن سنگ هاي رسوبي پوسته را مي سازد. باريم فلزي است قليايي(آلكالن)خاكي به رنگ سفيد- نقره اي با نماد Ba، عدد اتمي 56، وزن اتمي 327/137، وزن مخصوص 59/3 گرم بر سانتي متر مکعب، سختي 25/1 در مقياس موس، نرم، سنگين، نقطه جوش 1898 درجه سانتي گراد و نقطه ذوب بالا 729 درجه سانتي گراد. باريم در گروه 2(II) جدول تناوبي به عنوان فلز قليايي(آلكالن)خاكي Alkali Earth Metals بوده و در دوره 6 قرار دارد. باريت عموما"حاوي ناخالصيهايي است كه باعث كاهش وزن مخصوص آن مي گردد. علاوه برآن وجود ادخلها درباريت طبيعي نيز مي تواند وزن مخصوص آن را به نحو چشمگيري كاهش دهد. سختي باريت بين 3 تا 5/3 است. از لحاظ اقتصادي با توجه به ميزان سهولت در آسيب پذيري باريت، اصطلاحات " سخت " و " نرم " به آن نسبت داده مي شود. رنگ خاكه آن اكثرا"سفيد مي باشد و گاهي در اثر مالش يا خراشيده شدن، بودار مي شود كه برخي اين بو را مربوط به حضور مواد كربناته مي دانند. اگر باريت كاملا"خالص باشد به صورت بي رنگ و شفاف است، ولي باريت خالص بندرت يافت مي شود ودر اغلب موارد، وجود ادخل ها و ناخالصي ها در باريت باعث ايجاد رنگهاي متنوع درآن مي شود. به عنوان مثال در اثر وجود ادخلهاي گاز يا مايع به رنگ سفيد، حضور ادخلهاي آهن به رنگ قرمز و وجود ادخلها هيدروكسيد آهن باعث ايجاد رنگ زرد يا قهوه اي در اين كاني مي شود، علاوه برآن وجود مواد آلي ( مواد هيدروكربن يا بيتومينه ) آنرا به رنگ تيره يا سياه در مي آورد. در صورت وجود ادخال يا ناخالصي اين كاني در مقابل نور كدر بوده و درصورت داشتن رنگ سفيد با مرمر سفيد و خاكي شباهت پيدا مي كند. جلاي اين كاني شيشه اي تا چرب و گاهي مرواريدي است. اين كاني داراي سه سيستم رخ (كليواژ ) مي باشد كه كاملترين آنها به موازات {001} است. باريت در بيشتر موارد شكننده و داراي سطح شكست ناصاف است. اين كاني اغلب همراه با كانيهاي كالكوپيريت، كلسيت، پيريت، كوارتز، وانادينيت، سروسيت و فلوئورين يافت مي شود.
تعداد صفحات : 2
داریوش سلامی ..................................................................................... کارشناسی ارشد شیمی فیزیک................................................................... دبیرشیمی ناحیه1رشت .......................................................................... .shimisalami@yahoo.com ................................................................ شیمی یکی از مهمترین علوم پایه است که نقش کلیدی در زندگی بشر امروزی دارد و هر جنبه از زندگی ما ارتباط نزدیکی با این علم دارد.


 1xbet is a scam site
1xbet is a scam site شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی
شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی آنیون ها و کاتیون ها
آنیون ها و کاتیون ها