خود – یونش:
طبق آزمایشات صورت گرفته آب خالص در دمای 25℃ می تواند یونش یابد:
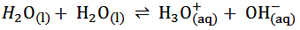
به این واکنش، واکنش خود – یونش آب می گویند. همواره در آب خالص مقادیر ناچیزی از یون های H3O(aq)+ و
OH(aq)- وجود دارد که از یونش جزیی مولکول آب طی این واکنش تعادلی ایجاد می شوند و رسانایی اندک آب خالص نیز به وجود آنها نسبت داده می شود. یکی از مولکول های H2O در نقش اسید و دیگری در نقش باز است و این واکنش هم نشان می دهد آب یک ماده ی آمفوتر است. توجه داشته باشید فرایند خود – یونش آب با مدل لوری – برونستد توجیه می شود نه مدل آرنیوس. آب از نظر آرنیوس فقط حلال است.
ثابت یونش آب:
اگر برای واکنش خود – یونش آب ثابت تعادل را بنویسیم به این شکل می شود:
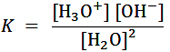
همان طور که می دانید غلظت آب ثابت بوده و می تواند به طرف چپ معادله برده شود:
به حاصلضرب K.[H2O]² ثابت یونش آب یا حاصلضرب یونی آب گفته می شود که آن را با نماد Kw نشان می دهند.
نکته: آزمایشات و اندازه گیری های تجربی نشان داده که در دمای 25℃ ثابت یونش آب برابر 10-14 است.
نکته: از رابطه ی یک و دو می توان نتیجه گرفت که:

از آنجاییکه Kw بسیار کوچک است می توان P این پارامتر را به دست آورد و به عدد ملموس تری رسید.
PKw= -logKw= -log10-14=14

نکته: یکای ثابت یونش آب mol2. lit-2 است.
سوال: با افزودن مقداری HCl به آب مقطر، غلظت یون هیدرونیم و یون هیدروکسید و حاصلضرب یونی آب چه تغییری می کند؟
جواب: با توجه به رابطه ی Kw می توان فهمید که غلظت H3O+ با غلظت OH- رابطه ی عکس دارد و از آنجاییکه با افزودن یک اسی
د) مانند HCL غلظت یون هیدرونیم افزایش می یابد، غلظت یون هیدروکسید کاهش خواهد یافت امّا حاصلضرب یونی آب ثابت می ماند، چون Kw مانند هر ثابت تعادل دیگری تنها با دما تغییر می کند و اضافه کردن اسید یا باز به آب مقدار آن را تغییر نمی دهد.
سوال: کدام عبارت درست است؟
1- در واکنش خود – یونش آب، مولکول های آب هم نقش اسید آرنیوس و هم نقش باز آرنیوس را دارند.
2- حاصلضرب یونی آب به دما و اسیدی یا بازی بودن محیط بستگی دارد.
3- ثابت یونش آب یکا ندارد.
4- واکنش خود – یونش آب مثالی از واکنش های اسید – باز است.


 فرمول نویسی فقط در یک صفحه A4
فرمول نویسی فقط در یک صفحه A4  فشار هوا چیست؟
فشار هوا چیست؟ جزوه شیمی 2
جزوه شیمی 2