به نام خدا
نام و نام خانوادگی : محمد رضا علیزاده
کلاس 03
مدرسه شهید نصیری
چرخه آب
این حقیقت است كه آبی كه امروزه مورد استفاده قرار می دهیم، صدها میلیون سال است كه وجود دارد و مقدار آن خیلی تغییر نكرده است. آب در سرتاسر دنیا حركت می كند، شكل آن تغییر می كند، توسط گیاهان و جانوران جذب می شود اما هرگز ناپدید نشده و از بین نمی رود. آب چرخه ای عظیم و دائمی را طی می كند كه آن را چرخه آب می نامیم(هیدرو به معنی آب است).
فرآیندهای متعددی با هم در كارند و سبب می شوند كه آبهای زمین به صورت چرخه دائما در حركت باشند. در چرخه آب پنج فرآیند دخیلند: تراكم، بارش، نفوذ، روان آب و تبخیرو تعریق. این فرآیندها همزمان بوده و به غیر از بارش، بقیه دائمی می باشند.
این پنج فرآیند، تراكم، بارش، نفوذ، روان آب و تبخیرو تعریق، با هم چرخه آب را می سازند. بخار آب متراكم شده و ابرها را تشكیل می دهدكه در شرایط مناسب منجر به بارش می شود. باران به سطح فرو می ریزد و به خاك نفوذ می كند یا به صورت روان آب جریان می یابد. آب سطحی(مثل دریاچه ها، رودخانه ها، اقیانوسها و غیره) تبخیر شده و به صورت رطوبت به جو بر می گردند در حالیكه گیاهان طی فرآیند تعریق، آب را به جو برمی گردانند.
تراكم فرآیندی است كه طی آن آب از حالت بخار به حالت مایع تبدیل می شود. غالبا بخار آب موجود در هوا، در اثر همرفت به سمت بالا می رود. یعنی هوای گرم و مرطوب بالا رفته و هوای سرد به سمت پایین حركت می كند. همانطور كه هوای گرمتر بالا می رود، بخار آب انرژی خود را از دست داده و حرارت آن افت می كند. در نتیجه، بخار آب به حالت مایع یا یخ در می آید.
می توانید در عمل،فرآیند تراكم را مشاهده كنید، هنگامیكه بطری لیموناد سردی را از یخچال برداشته و آن را در هوای اتاق قرار می دهید. دقت كنید كه لیموناد چگونه خارج می شود. آب نمی تواند از داخل بطری خارج شود بلكه به صورت بخار آب به هوا وارد می شود. همانطور كه هوای اطراف سرد می شود، آب به صورت قطره در می آید.
بارش، آبی است كه به صورت باران، تگرگ یا برف از ابرها می بارد. بارش وقتی آغاز می شودكه بخار آب متراكم شده و در اتمسفر سنگین شود. در نتیجه نمی تواند در جریان هوای اتمسفر باقی بماند و فرو می ریزد. در بعضی موارد، آب بارش، قبل از اینكه به سطح برسد، تبخیر می شود. اگرچه در اكثر موارد،آب بارش به سطح زمین می رسد و در سطح جریان می یابد، علاوه بر آن آب سطحی دررودخانه ها و دریاچه ها هم جمع می شود یا با نفوذ به خاك، آب زیرزمینی را تشكیل می دهد.
بخشی از بارش كه به سطح زمین می رسد، طی فرآیند نفوذ به داخل زمین می رود. میزان آبی كه به زمین نفوذ می كند بسته به درجه شیب زمین، میزان و نوع پوشش گیاهی، نوع خاك و سنگ و میزان اشباع شدگی خاك، متفاوت است. وجود سوراخهای بیشتر(تركها، حفره ها، درزه ها)، میزان نفوذ را افزایش می دهد. آبی كه به خاك نفوذ نكند، در سطح به صورت روان آب جاری می شود.
بارشی كه به سطح زمین می رسد اما به خاك نفوذ نمی كند روان آب نامیده می شود. روان آب در نتیجه ذوب برف و یخ هم به وجود می آید.
هنگامی كه میزان بارش زیاد است، خاكها از آب اشباع می شوند. با افزایش بارش، آب اضافی نمی تواند به خاك وارد شود. روان آب به رودخانه ها و رودها وارد شده و مقدار زیادی از آب اضافی جریان می یابد. آب سطحی همیشه به سمت پایینترین نقطه ممكن، معمولا اقیانوسها، حركت می كند. در طول این مسیر، بخشی از آب تبخیر می شود، بخشی به زمین نفوذ كرده یا برای مقاصد كشاورزی یا صنعتی مورد استفاده قرار می گیرد.
تبخیر و تعریق، آبی است كه از زمین تبخیر شده و یا توسط گیاهان تعریق می شود. تبخیر و تعریق، راهی برای ورود مجدد بخار آب به هواست.
تبخیر، هنگامی رخ می دهد كه انرژی تابشی خورشید، آب راگرم كرده و سبب می شود كه ملكولهای آب فعال شوند در نتیجه بخشی از آنها، به صورت بخار وارد اتمسفر می شوند.
تعریق، هنگامی رخ می دهد كه گیاهان آب را توسط ریشه جذب كرده و آن را از طریق برگها پس می دهند كه این فرآیند به علت حذف و انتقال آلاینده ها، آب را تمیز می كند.
همانطور كه دیدید، فرآیندهای بسیاری در جریان هستند تا آب مورد نیاز شما تامین شود. این فرآیندها همیشه در جریان هستند. اگر قطب جنوب یخ زده است، به آن معنا نیست كه در آن تبخیر رخ نمی دهد(یخ می تواند مستقیما، طی فرآیندی كه تصعید نامیده می شود، به بخار تبدیل شود و اگر بیابان ساهارا بسیار داغ است، به آن معنا نیست كه در آن بارندگی صورت نمی گیرد(بارش قبل از این كه به زمین برسد، تبخیر می شود).بنابراین، آبی كه شما امروزه می نوشید، هنگامی كه دایناسورها به زمین حكمفرمایی می كردند، وجود داشته است
نگاه اجمالی
میزان انحلال پذیری یک ماده حل شونده در یک حلال به طور قابل توجهی به ماهیت و قدرت نیروهای جاذبه بین ذرات حل شونده - حل شونده ، حلال - حلال و حل شده - حلال بستگی دارد. بیشترین انحلال وقتی مشاهده میشود که این نیروها همانند باشند، یعنی نخستین قاعده انحلال پذیری این است که "نظیر در نظیر حل می شود." بطور کلی ، مواد قطبی فقط در حلالهای قطبی و مواد ناقطبی فقط در حلالهای ناقطبی حل میشوند. یعنی مواد ناقطبی و مواد قطبی معمولا امتزاج ناپذیرند.
مثلا تتراکلریدکربن (یک ماده ناقطبی) در آب نامحلول است. زیرا نیروی جاذبه به یک مولکول آب نسبت به یک مولکول دیگر قویتیر از نیروی جاذبه بین یک مولکول تتراکلریدکربن و یک مولکول آب است از این رو، مولکولهای تتراکلریدکربن رانده میشوند و این دو ماده ، یک سیستم مایع دو لایهای تشکیل میدهد.
بلورهای مشبک (مثلا الماس) که در آنها اتمهای تشکیل دهنده بلور با پیوند کووالانسی به یکدیگر پیوستهاند، در تمام مایعات نامحلولاند. این ساختار بلورین بسیار پایدارتر از آن است که با فرآیند انحلال از هم بگسلد یعنی هیچ جاذبه بالقوه بین حلال - حل شونده نمیتواند به قدرت پیوند کووالانسی موجود در این نوع بلور برسد.
فرایند انحلال
میان مولکولهای کووالانسی ناقطبی ، تنها نیروهای بین مولکولی موجود ، نیروی لاندن است. ولی نیروهای جاذبه بین مولکولهای کووالانسی قطبی علاوه بر نیروهای لاندن ، نیروهای دو قطبی - دو قطبی را نیز شامل میشود. در مواردی که پیوند هیدروژنی وجود دارد، نیروهای بین مولکولی بطور غیر عادی قوی است. از آنجایی که مواد ناقطبی فقط در حلالهای ناقطبی حل میشوند، ید که یک ماده ناقطبی است، در تتراکلریدکربن حل میشود.
نیروی جاذبه بین مولکولهای I2 در ید جامد ، تقریبا از همان نوع و اندازهای است که بین مولکولهای CCl4 در تتراکلریدکربن خالص وجود دارد و از این رو، جاذبه ای قابل توجه بین ید و تتراکلرید کربن ممکن میگردد و مولکولهای ید میتوانند با مولکولهای تتراکلریدکربن ممزوج شوند و محلول حاصل یک مخلوط مولکولی بی نظم است. متیل الکل (CH3OH) و آب (هر دو ماده قطبی) به هر نسبت در یکدیگر حل میشوند. در محلول متیل الکل و آب ، مولکولهای CH3OH و H2O با پیوند هیدروژنی به هم پیوستهاند که در حالت مایع خالص نیز مولکولهای هر دو مایع بوسیله پیوند هیدروژنی به یکدیگر جذب میشوند.
مایعات قطبی (بویژه آب) میتوانند حلال بسیاری از ترکیبات یونی باشند. یونهای مواد حل شده توسط مولکولهای قطبی با نیروی الکتروستاتیکی جذب میشوند، یعنی یونهای منفی توسط قطبهای مثبت مولکولهای حلال و یونهای مثبت توسط قطبهای منفی این مولکولها جذب میشوند. این جاذبه یون - دو قطبی ممکن است نیروهای نسبتا قوی باشند و موجب میشود که یونها از بلور جدا شده و در فاز مایع شناور شوند. یونهای حل شده آبپوشیدهاند و در حالی که با غلافی از مولکولهای آب احاطه شدهاند در محلول حرکت میکند.
اثر دما بر انحلال پذیری
اثر تغییر دما بر انحلال پذیری یک ماده به جذب شدن یا آزاد شدن گرما به هنگام تهیه محلول سیر شده آن ماده بستگی دارد. با استفاده از اصل لوشاتلیه می توان اثر تغییر دما بر روی انحلال پذیری یک ماده را پیش بینی کرد. اگر فرآیند انحلال ماده حل شونده ، فرآیندی گرماگیر باشد، انحلال پذیری آن ماده با افزایش دما افزایش مییابد.
حل شده موجود در محلول سیر شده <----> حل شونده جامد + انرژی
اگر انحلال ماده حل شونده فرآیندی گرماده باشد، با افزایش دما ، انحلال پذیری ماده حل شونده کاهش مییابد. معدودی از ترکیبات یونی ( مثل Na2CO3 , Li2CO3 ) بدین گونه عمل میکنند. علاوه بر این ، انحلال پذیری تمام گازها با افزایش دما ، کاهش پیدا میکند. مثلا با گرم کردن نوشابههای گازدار ، گاز دیاکسید کربن موجود در آنها از محلول خارج میشود. تغییر انحلال پذیری با تغییر دما به مقدار آنتالپی انحلال بستگی دارد. انحلال پذیری موادی که آنتالپی انحلال آنها کم است، با تغییر دما تغییر چندانی نمیکند.
اثر فشار بر انحلال پذیری
اثر تغییر فشار بر انحلال پذیری مواد جامد و مایع معمولا کم است ولی انحلال پذیری گازها در یک محلول با افزایش یا کاهش فشاری که به محلول وارد میشود، به میزان قابل توجهی تغییر میکند. "ویلیام هنری" در سال 1803 میلادی کشف کرد که مقدار گازی که در یک دمای ثابت در مقدار معینی از یک مایع حل میشود با فشار جزئی آن گاز در بالای محلول نسبت مستقیم دارد. فقط محلولهای رقیق در فشارهای نسبتا پایین از قانون هنری به خوبی پیروی میکنند. گازهایی که انحلال پذیری آنها بسیار زیاد است، عموما با حلال خود ترکیب میشود (مثلا گاز هیدروژن کلرید وقتی که حل میشود، با آن ترکیب شده و هیدروکلریک اسید تولید میکند). این محلولها از قانون هنری پیروی نمیکنند.
خون غواصها در عمق دریا تحت فشار نسبتا زیاد ویژه عمقی که در آن کار میکنند با هوا سیر میشود. اگر این فشار ، در اثر بالا آمدن سریع سطح آب به سرعت برداشته شود، هوا به سرعت از محلول خارج شده و حبابهایی را در سیستم جریان خون غواص ایجاد میکند. این حالت که "آمبولی هوایی" نام دارد، بر تحریکات عصبی و سیستم جریان خون اثر گذاشته و ممکن است مرگ آور باشد. برای پیشگیری از این حادثه از جو هلیوم و اکسیژن به جای هوا که بخش عمده آن اکسیژن و نیتروژن است استفاده میشود، زیرا انحلال پذیری هلیوم در خون و مایعات بدن بسیار کمتر از نیتروژن است.
تعادلهای انحلال
تعادل مایع - مایع (حل شدن برم در آب)
هر گاه 50 گرم برم را که مایعی است قرمز رنگ ، فرار و سمی در ظرف محتوی یک لیتر آب بریزیم، دو لایه قرمز و بی رنگ پدید میآید. با گذشت زمان برم در آب حل میشود و محلول کم کم پر رنگ میشود و بالاخره تغییر متوقف میشود. گر چه مایع برم هنوز در ته ظرف وجود دارد (در حدود 14 گرم). در این شرایط که محلول برم در مجاورت برم خالص قرار دارد و هیچگونه تغییری مشهود نیست، میگوییم سیستم در حال تعادل است. ویژگی مهم تعادل ، تغییر ناپذیری خواص ماکروسکوپی آن است. خواص ماکروسکوپی ، خواصی است که به مقدار زیادی از ماده وابسته است به اندازهای که قابل مشاهده و اندازه گیری باشد و تغییرات آنها آشکار شود.
تعادل جامد - مایع (حل شدن نمک طعام در آب)
هر گاه مقداری زیادی بلورهای نمک طعام (در حدود 500 گرم) را به یک لیتر آب بیفزاییم و مخلوط را بهم بزنیم چون هم زدن را تا 10 دقیقه ادامه دهیم، خواهیم دید که مقدار زیاد نمک حل میشود و فقط 140 گرم آن باقی میماند که با بهم زدن زیاد هم از وزن نمک موجود در ته ظرف کاسته نمیشود. بنابراین میگوییم که به حالت ثابتی رسیده و سیستم در حال تعادل است، زیرا خواص ماکروسکوپی آن تغییر نمی کند. در حقیقت پدیده تعادل در سیستم جامد - مایع آب نمک شامل دو فرآیند است که در حال رقابت با یکدیگرند.
در ابتدا که نمک را در آب ریختیم، فرآیند حل شدن که شامل یونیزه شدن NaCl به کاتیونهای سدیم و آنیونهای کلر است، اغلب در یک جهت معینی از بلور به سوی محلول انجام میگیرد. با پیشرفت فرآیند حل شدن و افزایش غلظت یونها در محلول ، واکنش معکوس نیز امکان پذیر میشود. یعنی افزوده شدن یونهای محلول به بلور (تبلور یا رسوب کردن) انجام میشود. مادام که موازنه این دو فرایند برقرار است، مقدار نمک حل شده در واحد حجم محلول ثابت خواهد بود و سیستم در تعادل انحلال پذیری باقی خواهد ماند.
تعادل گاز- مایع (حل شدن گاز CO2 در آب)
انحلال گازها در مایعات با دما نسبت عکس و با فشار نسبت مستقیم دارد. مکانیسم حل شدن گاز در مایع ، کم و بیش مشابه حل شدن جامد در مایع و مایع در مایع است. هر گاه بوسیله یک لوله گاز دیاکسید کربن را در آب موجود در یک ظرف بدمیم، حبابهای درشت گاز که وارد آب میشوند، بتدریج کوچک شده و حتی ممکن است ناپدید شوند و این نشانه حل شدن جزئی آنهاست. با ادامه دمیدن ، به مرحلهای میرسیم که آب بوسیله گاز سیر میشود و دیگر حبابهای گاز بدون کاهش حجم خارج میشوند. در این شرایط در دما و فشار هوای اطاق ، غلظت گاز در آب ثابت میماند و به عبارتی تعادل زیر برقرار میشود:
(محلول) CO2 <----> (گاز) CO2


 فرمول نویسی فقط در یک صفحه A4
فرمول نویسی فقط در یک صفحه A4 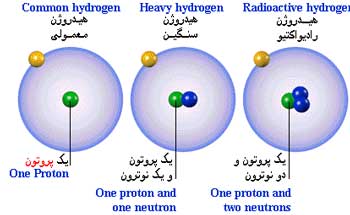 ایزوتوپ - سعید رفیع زاده
ایزوتوپ - سعید رفیع زاده