نام : سهاب زمانی
مدرسه:ملاصدرا
کلاس:05
موضوع:نظریه جنبشی گاز ها
نگاه اجمالی
در ترمودینامیک فقط با متغیرهای ماکروسکوپیک ، مانند فشار و دما و حجم سر و کار داریم. قوانین اصلی ترمودینامیکها بر حسب چنین کمیتهایی بیان میشوند. ابدا درباره این امر که ماده از اتمها ساخته شده است صحبتی نمیکنند. لیکن مکانیک آماری ، که با همان حیطهای از علم سر و کار دارد که ترمودینامیک از آن بحث میکند و وجود اتمها را از پیش مفروض میداند. قوانین اصلی مکانیک آماری حامی قوانین مکانیکاند که در حدود اتمهای تشکیل دهنده سیسنم بکار میروند.
تاریخچه
نظریه جنبشی توسط رابرت بویل (Rabert Boyle) (1627 – 1691) ، دانیل برنولی (1700 – 1782) ، جیمز ژول (1818 – 1889) ، کرونیگ (1822 – 1874) ،رودولف کلاوسیوس (1822 – 1888) و کلرک ماکسول ( 1831 – 1879 ) و عدهای دیگر تکوین یافته است. در اینجا نظریه جنبشی را فقط در مورد گازها بکار میبریم، زیرا برهم کنشهای بین اتمها ، در گازها به مراتب متغیرترند تا در مایعات. و این امر مشکلات ریاضی را خیلی آسانتر میکند.
در سطح دیگر میتوان قوانین مکانیک را بطور آماری و با استفاده از روشهایی که صوریتر و انتزاعیتر از روشهای نظریه جنبشی هستند بکار برد. این رهیافت که توسط جی ویلارد گیبس (J.willard Gibbs) و لودویگ بولتز مانی (Ludwig Boltz manni) (1844 – 1906) و دیگران تکامل یافته است، مکانیک آماری نامیده میشود، که نظریه جنبشی را به عنوان یکی از شاخههای فرعی در بر میگیرد. با استفاده از این روشها میتوان قوانین ترمودینامیک را به دست آورد. بدین ترتیب معلوم میشود که ترمودینامیک شاخهای از علم مکانیک است.
محاسبه فشار بر پایه نظریه جنبشی
فشار یک گاز ایدهآل را با استفاده از نظریه جنبشی محاسبه میکنند. برای ساده کردن مطلب ، گازی را در یک ظرف مکعب شکل با دیوارههای کاملا کشسان در نظر میگیریم. فرض میکنیم طول هر ضلع مکعب L باشد. سطحهای عمود بر محور X را که مساحت هر کدام e2 است. A1 و A2 مینامیم. مولکولی را در نظر میگیریم که دارای سرعت V باشد. سرعت V را میتوان در راستای یالهای مولفههای Vx و Vy و Vz تجزیه کرد.
اگر این ذره با A1 برخورد کند در بازگشت مولفه X سرعت آن معکوس می شود. این برخورد اثری رو ی مولفه Vy و یا Vy ندارد در نتیجه متغیر اندازه حرکت عبارت خواهد بود :
m Vx - m Vx) = 2 m Vx -) = اندازه حرکت اولیه – اندازه حرکت نهایی
که بر A1 عمود است. بنابراین اندازه حرکتی e به A1 داده میشود برابر با m Vx2 خواهد بود زیرا اندازه حرکت کل پایسته است.
زمان لازم برای طی کردن مکعب برابر خواهد بود با Vx/L. در A2 دوباره مولفه y سرعت معکوس میشود و ذره به طرف A1 باز میگردد. با این فرض که در این میان برخوردی صورت نمیگیرد مدت رفت و برگشت برابر با 2 e Vx خواهد بود. به طوری که آهنگ انتقال اندازه حرکت از ذره به A1 عبارت است:
mVx2/e = Vx/2e . 2 mVx ، برای به دست آوردن نیروی کل وارد بر سطح A1 ، یعنی آهنگ انتقال اندازه حرکتی از طرف تمام مولکولهای گاز به A1 داده میشود.
(P = M/e(Vx12 + Vx22 + Vx32
P = 1/2eV2
تعبیر دما از دیدگاه نظریه جنبشی
با توجه به فرمول RT 2/3 = 1/2 MV2 یعنی انرژی کل انتقال هر مول از مولکولهای یک گاز ایدهآل ، با دما متناسب است. میتوان گفت که این نتیجه با توجه به معادله بالا برای جور در آمدن نظریه جنبشی با معادله حالت یک گاز ایدهآل لازم است. و یا اینکه میتوان معادله بالا را به عنوان تعریفی از دما بر پایه نظریه جنبشی یا بر مبنای میکروسکوبیک در نظر گرفت. هر دو مورد بینشی از مفهوم دمای گاز به ما میدهد. دمای یک گاز مربوط است به انرژی جنبشی انتقال کل نسبت به مرکز جرم گاز اندازه گیری میشود. انرژی جنبشی مربوط به حرکت مرکز جرم گاز ربطی به دمای گاز ندارد.
حرکت کاتورهای را به عنوان بخشی از تعریف آماری یک گاز ایدهآل در نظر گرفت. V2 را بر این اساس میتوان محاسبه کرد. در یک توزیع کاتورهای سرعتهای مولکولی ، مرکز جرم در حال سکون خواهد بود. بنابراین ما باید چارچوب مرجعی را بکار ببریم که در آن مرکز جرم گاز در حال سکون باشد. در چارچوبهای دیگر ، سرعت هر یک از مولکولها به اندازه U (سرعت مرکز جرم در آن چارچوب) از سرعت آنها در چارچوب مرکز جرم بیشتر است. در اینصورت حرکتها دیگر کترهای نخواهد بود و برای V2 مقادیر متفاوتی بدست میآید. پس دمای گاز داخل یک ظرف در یک قطار متحرک افزایش مییابد. میدانیم که M V2 1/2 میانگین انرژی جنبشی انتقالی هر مولکول است. این کمیت در یک دمای معین که در این مورد صفر درجه سلسیوس است، برای همه گازها مقدار تقریبا یکسانی دارد. پس نتیجه میگیریم که در دمای T ، نسبت جذر میانگین مربعی سرعتهای مولکولهای دو گاز مختلف مساوی است با ریشه دمای عکس نسبت به مربعهای آنها.
T = 2/3k m1 V12/2= 2/3k m2 V22/2
مسافت آزاد میانگین
در فاصله برخوردهای پیدرپی ، هر مولکول از گاز با سرعت ثابتی در طول یک خط راست حرکت میکند. فاصله متوسط بین این برخوردهای پیدرپی را مسافت آزاد میانگین مینامند. اگر مولکولها به شکل نقطه بودند، اصلا با هم برخورد نمیکردند. و مسافت آزاد میانگین بینهایت میشد. اما مولکولها نقطهای نیستند و بدین جهت برخوردهایی روی میدهد. اگر تعداد مولکولها آنقدر زیاد بود که میتوانستند فضایی را که در اختیار دارند کاملا پر کنند و دیگر جایی برای حرکت انتقالی آنها باقی نمیماند. آن وقت مسافت آزاد میانگین صفر میشد.
بنابراین مسافت آزاد میانگین بستگی دارد به اندازه مولکولها و تعداد واحد آنها در واحد حجم. و به قطر d و مولکولهای گاز به صورت کروی هستند در این صورت مقطع برای برخورد برابر با лd2 خواهد بود.
مولکولی با قطر 2d را در نظر میگیریم که با سرعت V در داخل گازی از ذرات نقطهای هم ارز حرکت میکند. این مولکول در مدت t استوانهای با سطح مقطع лd2 و طول Vt را میروبد. اگر nv تعداد مولکولها در واحد حجم باشد استوانه شامل (лd2 Vt ) nv ذره خواهد بود. مسافت آزاد میانگین ، L ، فاصله متوسط بین دو برخورد پیدرپی است بنابراین ، L ، عبارت است از کل مسافتی که مولکول در مدت t میپیماید. (Vt) تقسیم بر تعداد برخوردهایی که در این مدت انجام میدهد. یعنی:
I = Vt/πd2nv =1/√2πnd2
I = 1/√2πnd2
این میانگین بر مبنای تصویری است که در آن یک مولکول با هدفهای ساکن برخورد میکند. در واقع ، برخوردهای مولکول با هدف دمای متحرک انجام میگیرد در نتیجه تعداد برخورد دما از این مقدار بیشتر است.
توزیع سرعتهای مولکولی
با توجه به سرعت جذر میانگین مربعی مولکولهای گاز ، اما گستره سرعتهای تکتک مولکولها بسیار وسیع است. بطوری که برای هر گازی منحنیای از سرعتها مولکولی وجود دارد که به دما وابسته است. اگر سرعتهای تمام مولکولهای یک گاز یکسان باشند این وضعیت نمیتواند مدت زیاد دوام بیاورد. زیرا سرعتهای مولکولی به علت برخوردها تغییر خواهند کرد. با وجود این انتظار نداریم که سرعت تعداد زیادی از مولکولها بسیار کمتر از Vrms (یعنی نزدیک صفر) یا بسیار بیشتر از Vrms ، زیرا وجود چنین سرعتهایی مستلزم آن است که یک رشته برخوردهایی نامحتمل و موجی صورت بگیرد. مسئله محتملترین توزیع سرعتها در مورد تعداد زیادی از مولکولهای یک گاز را ابتدا کلوک ماکسول حل کرد. قانونی که او ارائه کرد در مورد نمونهای از گاز که N مولکول را شامل میشد چنین است :
N(V) = 4πN(m/2πKt)3/2V2e-mv2/2kt
در این معادله N(V)dV تعداد مولکولهایی است که سرعت بین V و V+3v است، T دمای مطلق ، K ثابت بولتزمن ، m جرم هر مولکول است. تعداد کل مولکولهای گاز (N) را ، با جمع کردن (یعنی انتگرالگیری) تعداد موجود در هر بازه دیفرانسیلی سرعت از صفر تا بینهایت به دست میآید. واحد (N(V میتواند مثلا مولکول برا سانتیمتر بر ثانیه باشد.
N =∫∞0N(V)dv
توزیع سرعتهای مولکولی در مایعات
توزیع سرعتهای مولکولی در مایعات شبیه گاز است. اما بعضی از مولکولهای مایع (آنهایی که سریعترند) میتوانند در دماهایی کاملا پایینتر از نقطه جوش عادی از سطح مایع بگریزند. (یعنی تبخیر شوند). فقط این مولکولها هستند که میتوانند بر جاذبه مولکولهای سطح فائق آیند. و در اثر تبخیر فرار کنند. بنابراین انرژی جنبشی میانگین مولکولهای باقیمانده نیز کاهش مییابد در نتیجه دمای مایع پایین میآید. این امر روشن میکند که چرا تبخیر فرایند سرمایشی است.
مثال واقعی در مورد توزیع سرعتهای مولکولی
با توجه به فرمول N(V) = Σ410N(M/2πkT)3/2 توزیع سرعتهای مولکولی هم به جرم مولکول و هم به دما بستگی دارد هرچه جرم کمتر باشد نسبت مولکولهای سریع در یک دمای معین بیشتر است. بنابراین احتمال اینکه هیدروژن در ارتفاعات زیاد از جو فرار کند بیشتر است، تا اکسیژن و ازت. کره ماه دارای جو رقیقی است. برای آنکه مولکولهای این جو احتمال زیادی برای فرار از کشش گرانشی ضعیف ماه ، حتی در دماهای پایین آنجا نداشته باشند، انتظار میرود که این مولکولها یا اتمها متعلق به عناصر سنگینتر باشند. طبق شواهدی ، در این جو گازهای بی اثر سنگین مانند کریپتون و گزنون وجود دارند که براثر واپاشی پرتوزا در تاریخ گذشته ماه تولید شدهاند. فشار جو ماه در حدود 10 برابر فشار جو زمین است.
توزیع ماکسولی
ماکسول قانون توزیع سرعتهای مولکولی را در سال 1859 میلادی به دست آورد. در آن زمان بررسی این قانون به کمک اندازه گیری مستقیم ممکن نبود و در حقیقت تا سال 1920 که اولین کوشش جدی در این راه توسط اشترن (Stern) به عمل آمد، هیچ اقدامی صورت نگرفته بود. افراد مختلفی تکنیکهای این کار را به سرعت بهبود بخشیدند. تا اینکه در سال 1955 یک بررسی تجربی بسیار دقیق در تائید این قانون (در مورد مولکولهای گاز توسط میلر (Miller) و کاش (Kusch) از دانشگاه کلمبیا صورت گرفت.
اسبابی که این دو نفر بکار بردند در مجموعهای از آزمایشها مقداری تالیوم در کوره قرار میدادند و دیوارههای کوره O را تا دمای یکنواخت 80±4K گرم کردند. در این دما تالیوم بخار میشود و با فشار 3.2x10-3 میلیمتر جیوه ، کوره را پر میکند. بعضی از مولکولهای بخار تالیوم از شکاف s به فضای کاملا تخلیه شده خارج کوره فرار میکند و روی استوانه چرخان R میافتند در این صورت استوانه که طولش L است تعدادی شیار به صورت مورب تعبیه شده که فقط یکی از آنها را میتوان دید. به ازای یک سرعت زاویهای معین استوانه (W) فقط مولکولهایی که دارای سرعت کاملا مشخص V هستند میتوانند بدون برخورد با دیوارهها از شیارها عبور کنند. سرعت V را میتوان از رابطه زیر بدست آورد:
V = LW/q و L/V = φ/W = زمان عبور مولکول از شیار
φ: تغییر مکان زاویهای بین ورودی و خروجی یک شیار مورب است. استوانه چرخان یک سرعت گزین است، سرعت انتخاب شده با سرعت زاویهای (قابل کنترل) W متناسب است.
نقص توزیع سرعت ماکسولی با نظریه جنبشی
اگرچه توزیع ماکسولی سرعت برای گازها در شرایط عادی سازگاری بسیار خوبی با مشاهدات دارد. ولی در چگالیهای بالا ، که فرضهای اساسی نظریه جنبشی کلاسیک صادق نیستند. این سازگاری نیز به هم میخورد. در این شرایط باید از توزیعهای سرعت مبتنی بر اصول مکانیک کوانتومی ، یعنی توزیع فرمی - دیراک(Fermi Dirac) بوز – انیشتین (Bose Einstein) استفاده کرد. این توزیعهای کوانتمی در ناحیه کلاسیک (چگالی کم) با توزیع ماکسولی توافق نزدیک دارند و در جایی که توزیع کلاسیک با شکست مواجه میشود با نتایج تجربی سازگارند. بنابراین در کاربرد توزیع ماکسولی محدودیتهایی وجود دارد. همانگونه که در واقع برای هر نظریهای چنین است.





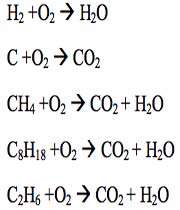










 1xbet is a scam site
1xbet is a scam site شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی
شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی