نظریه حالت گذار(به انگلیسی: Transition state theory) نظریه ای در سینتیک شیمیایی است که چگونگی انجام یک واکنش شیمیایی بین مواد واکنش دهنده و تولید فرآورده را توصیف می کند.در این نظریه مفهومی فرضی به نام حد واسط یا کمپلکس فعال معرفی می شود که عبارت است از ماده ای با سطح انرژی بالا که در آن پیوند های مواد واکنش دهنده در حال سست شدن و پیوند های مواد فرآورده در حال تشکیل است.با استفاده از نمودار مربوط به این تئوری می توان مقدار انرژی فعال سازی واکنش،آنتالپی واکنش و نوع واکنش(گرما گیر یا گرماده بودن)را تشخیص داد.
نظريه ي حالت گذار پيشنهاد مي كند هنگامي كه مولكول هاي واكنش دهنده به نزديكي همديگر مي رسند، به طور آني در حالتي با پايداري كم تر از پايداري حالت واكنش دهنده ها و محصولات خواهند بود.
در نظريه ي حالت گذار، مكانيسم اندركنش واكنش دهنده ها مطرح نيست؛ معيار مهم آن است كه مولكول هاي واكنش دهنده، انرژي كافي براي غلبه بر سد پتانسيل انرژي (انرژي فعال سازي) داشته باشند تا واكنش دهند.
در اين حالت با پايداري كم تر، اتمها خود را از نو آرايش مي دهند، پيوندهاي اصلي ضعيف مي شوند و پيوندهاي جديد اندكي تشكيل مي شوند.
انرژي پتانسيل سيستم در اين نقطه افزايش مي يابد؛ زيرا:
· مولكول هاي واكنش دهند هي در حال واكنش، بايد به نيروهاي دافعه ي متقابل بين الكترون هاي لايه ي بيروني تر اتم هاي سازنده ي خود غلبه كنند.
· اتم ها بايد هنگام شكسته شدن پيوندهايشان از هم جدا شوند.
براي يك واكنش دو مولكولي، حالت گذار هنگامي تشكيل مي شود كه پيوندهاي مولكول هاي قديمي، ضعيف مي شوند و پيوندهاي جديد شروع به شكل گيري مي كنند يا اين كه ابتدا پيوندهاي قديمي مي شكنند تا حالت گذار را شكل دهند و بعد از آن پيوندهاي تازه تشكيل مي شوند.
در مثال زير، حالت گذار اتفاق مي افتد:
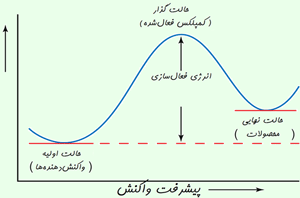
رسيدن به حالت گذار، انرژي زيادي لازم دارد؛ بنابراين اين حالت، مادهاي با انرژي زياد به وجود ميآيد. اين افزايش در انرژي پتانسيل با سد پتانسيلي متناظر است كه اگر واكنش به پيش رود، مولكولهاي واكنشدهنده بايد از آن عبور كنند.
آرايش اتمها در بيشينهي اين سد پتانسيل، كمپلكس فعال يا حالت گذار ناميده ميشود و يك حالت واسطهي گذرا بين واكنشدهندهها و محصولات است.
حالت گذار يا كمپلكس فعال شده، يك حالت تركيبي ناپايدار گذراي مولكولهاي واكنشدهنده است كه در يك بيشينهي انرژي پتانسيل اتفاق ميافتد.
اين تركيب هم مي تواند در جهت توليد محصولات به پيش رود و هم به سمت واكنش دهندههاي تغيير نيافته برگردد.
تفاوت انرژي بين واكنش دهنده ها و بيشينه ي انرژي پتانسيل به انرژي فعال سازي برمي گردد.
حركت واكنش از روي بيشينهي انرژي پتانسيل اغلب با دياگرام هماهنگ واكنش نشان داده مي شود.
افزايش در انرژي پتانسيل با سد پتانسيلي متناظر است كه اگر واكنش به پيش رود، مولكولهاي واكنشدهنده بايد از آن عبور كنند.

شكلهاي زير، نظريهي حالت گذار را با اشاره به واكنش بين هيدروژن و يد براي توليد يديد هيدروژن نشان ميدهد:
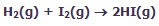
در اين فرايند، مولكول هاي واكنشدهنده به همديگر نزديك ميشوند و زماني كه آن ها در حين متعادلسازي واكنش براي حالت گذار يا كمپلكس فعالشده به پيش ميروند:
پيوندهاي اصلي ضعيف ميشوند.
پيوندهاي جديد نسبتاً تشكيل ميشوند.
در اين شكل، واكنش در حهت توليد محصول پيشرفت ميكند. اين شكلها را به دقت نگاه كنيد تا ضعيف شدن پيوندهاي اصلي و تشكيل پيوندهاي جديد را بعد از توليد محصولات ببينيد:
همان طور كه دما افزايش پيدا مي كند، سهم اجزاي واكنش دهندهاي كه مي توانند به بيشينه ي انرژي پتانسيل برسند، افزايش پيدا مي كند؛ افزايش تعداد مولكول ها ي محصول كه در هر ثانيه تشكيل مي شوند، آهنگ واكنش را افزايش مي دهد.
نكات كليدي:
افزايش دمايي مانند ١٠ K آهنگ واكنش بسياري از واكنش هاي شيميايي را تقريباً دو برابر مي كند.
نظريه ي برخورد بر پايه ي انرژي جنبشي است و فرض ميكند كه ذرات بايد داراي دو شرط جهت مناسب و انرژي جنبشي كافي باشند تا واكنش دهنده ها به محصول تبديل شوند.
كم ترين انرژي جنبشي لازم براي يك برخورد توسط مولكول هاي واكنش دهنده براي تشكيل محصولات، انرژي فعال سازي (Ea) ناميده ميشود.
نسبت مولكول هاي واكنش دهنده اي كه با انرژي جنبشي مساوي با انرژي فعال سازي واكنش مي دهند، با افزايش دما زياد مي شود.
نظريه ي حالت گذار پيشنهاد مي كند كه هنگام نزديك شدن مولكول هاي واكنش دهنده، يك كمپلكس فعال شده ي گذرا (حالت گذار) در بيشينه ي انرژي پتانسيل تشكيل مي شود.
در نظريه ي حالت گذار، انرژي فعال سازي، تفاوت انرژي بين واكنش دهنده ها و بيشينه ي انرژي پتانسيل است.
در كمپلكس فعالشده، پيوندهاي اصلي ضعيف شده و پيوندهاي جديد نسبتاً تشكيل ميشوند. كمپلكس فعالشده ممكن است در جهت توليد محصولات به پيش رود و يا به سمت واكنشدهندهها برگردد.
زماني كه دما افزايش پيدا مي كند، نسبت بزرگ تري از مولكول هاي واكنش دهنده مي تواند به بيشينه ي انرژي پتانسيل رسيده و كمپلكس فعال شده تشكيل دهند. بنابراين تعداد مولكول هاي محصول تشكيل شده در هر ثانيه افزايش پيدا مي كند.


 انواع الیاف و پارچه ها- مهیار سیدی
انواع الیاف و پارچه ها- مهیار سیدی  ویژگی های کربن
ویژگی های کربن