جدول مندليف:
- نخستين بار مندليف (Mendeleev) به وجود خصلت تناوبي در ميان عنصرها پي برد.
- مندليف بر اساس دو اصل زير، جدول تناوبي خود را تنظيم كرد:
1ـ قرار دادن عنصرها در رديف هايي كنار يك ديگر، بر حسب افزايش جرم اتمي.
2ـ قرار دادن عنصرها در گروه هايي زير يك ديگر، بر حسب تشابه خواص آن ها.
- مندليف براي رعايت اصل تشابه خواص، برخي خانه هاي جدولش را خالي گذاشت.
- مندليف خواص10 عنصر كشف نشده(در خانه هاي خالي جدولش) را پيش بيني كرد.
- خواص 8 عنصر از10 عنصر پيش بيني شده توسط مندليف، (پس از كشف) درست بود.
- اِكاآلومينيم، اِكابور و اِكاسيليسيم از جمله پيش بيني هاي درست مندليف بودند كه پس از كشف، به ترتيب: گاليم، اسكانديم و ژرمانيم ناميده شدند.
- مندليف براي رعايت اصل تشابه خواص، Iرا بعد از Te و Ni را بعد از Co قرار داد، با آن كه جرم اتمي I از Te و هم چنين Ni از Co كم تر است.
- مندليف معتقد بود كه بي نظمي هاي فوق، به دليل وجود خطا در اندازه گيري جرم اتمي اين عنصر ها است. (البته بعداً معلوم شد كه جرم اتمي ها، درست بوده اند!)
جدول تناوبي امروزي:
- مـوزلـي، مبنـاي تنـظيم عنصـر ها كه قبـلاً بر اسـاس «افزايش جرم اتمي» بود ، به «افزايش عدد اتمي» تغييرداد و در نتيجه بي نظمي هاي جدول مندليف قابل توجيه شد.
- مثلاً I داراي عدد اتمي 53 و Te داراي عدد اتمي 52 مي باشد، بنابراين I بايد بعد ازTe قرار گـيرد (گر چه جرم اتمي I از Te كم تر اسـت) ، هم چنين Ni با عدد اتمي 28 بايد بعد از Co با عدد اتمي 27 قرار گيرد (گر چه جرم اتمي Ni كم تر از Co است).
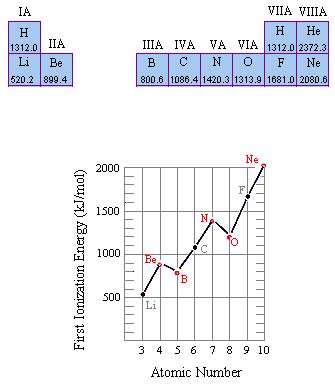
- قانون تناوبي: اگر عنصر ها را بر حسب افزايش عدد اتمي در كنار هم قرار دهيم، خواص فيزيكي و شيميايي آن ها، به صورت تناوبي تكرار مي شود.
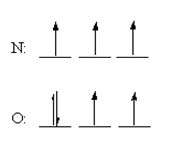
- مهـم تـرين نكـته در جـدول تنـاوبي، تشـابه آرايش الكـتروني عنصـرهاي يك گـروه (خانواده)، در اغلـب گروه ها مي باشـد. مثلاً تمـام عنصـر هاي گروه 1 (IA) به آرايش الكترونيns1 ختم مي شوند (n عدد كوانتومي اصلي يا شماره دوره ي تناوب است). بنابـراين دليـل تشـابه خواص شـيميايي عنصـر هاي هم گـروه، شباهـت آرايش هاي الكتروني آن ها به يك ديگر مي باشد.
- جدول تناوبي امروزي ، داراي 18 گروه (ستون) و 7 دوره ي تناوب (رديف) مي باشد.
بخش هاي مهم جدول تناوبي:
براي سرعت عمل بيش تر، لازم است كه موارد زير از جدول تناوبي حفظ شوند:
1- گروه هاي اصلي (IA,IIA,IIIA,IVA,VA,VIA,VIIA,VIIIA) از بالا به پايين.
2- عنصرهاي واسطه ي دوره ي چهارم (n=4) يعني از 21Sc تا 30Zn با شماره ي گروه.
3- عدد اتمي و نام عنصرهاي 1 تا 36 .
4- عدد اتمي و نام و موقعيت عنصرهاي گروه VIIIA يا 18 (گازهاي نجيب).
5- عدد اتمي و نام و موقعيت عنصرهاي لانتان 57La و اكتينيم 89Ac.
6- عنصرهاي شبه فلز (B,Si,Ge,As,Sb,Te).
7- عنصرهاي مايع (در دماي اتاق): شامل فلز جيوه Hg و نافلز برم Br.
8- عنصرهاي گاز (در دماي اتاق): شامل H، N، O، F، Cl و عنصرهاي گروه VIIIA.
9- تعداد كل عنصرها: 109 عنصر.
10- تعداد عنصرهايي كه در طبيعت يافت مي شوند: حدود 91 عنصر.
11- درصد فلزها در جدول تناوبي: حدود 80% عنصرها.
12- تعداد عنصرها در هر دوره ي تناوب:
|
توضيحات
|
تعداد عنصر
|
شماره ي دوره ي تناوب (n)
|
|
كوتاه ترين دوره ي تناوب
|
2
|
n = 1
|
|
|
8
|
n = 2
|
|
|
8
|
n = 3
|
|
|
18
|
n = 4
|
|
|
18
|
n = 5
|
|
طولاني ترين دوره ي تناوب
|
32
|
n = 6
|
|
دوره ي تناوب ناقص
|
23
|
n = 7
|
13- تعداد عنصرها در هر گروه:
|
18
|
17
|
16
|
15
|
14
|
13
|
12
|
11
|
10
|
9
|
8
|
7
|
6
|
5
|
4
|
3
|
2
|
1
|
|
6
|
5
|
5
|
5
|
5
|
5
|
3
|
3
|
3
|
4
|
4
|
4
|
4
|
4
|
4
|
32
|
6
|
7
|
طولاني ترين گروه جدول تناوبي، گروه 3 يا IIIB مي باشد. طولاني ترين گروه اصلي جدول تناوبي، گروه 1 يا IA مي باشد.
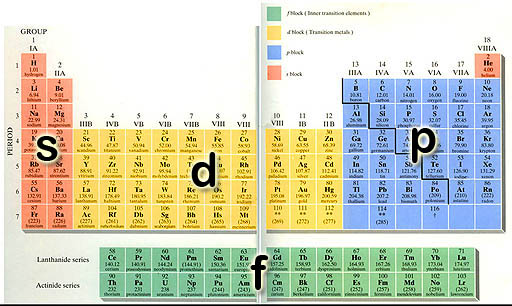
14- تعداد عنصرهاي موجود در هر دسته (s=14 ، p=30 ، d=37 و f=28).
نتيجه:
آ- آرايش الكتروني لايه ي ظرفيت عنصرها در گروه هاي اصلي (A):
ns2np2



 1xbet is a scam site
1xbet is a scam site شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی
شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی