افشین قاسمی
مدرسه شهید رجایی 1
بلوک افبخشی از جدول تناوبی است که شامل عناصری میشود که زیرلایهٔ اف آنها در حال پر شدن باشد. به این عناصر
فلزات واسطه داخلی نیز میگویند.[۱] عناصر دو دستهٔ لانتانیدها و آکتینیدها به جز لوتتیم و لورنسیم[۲] جزو بلوک اف هستند.
این عناصر که الکترونهای متمایز کننده اتم آنها، در ترازهای n-۲)F) لایه ظرفیت که ترازهای نسبتا درونیاند قرار میگیرند، به عناصر واسطه داخلی معروفند و جزو عنصرهای گروه III B در جدول تناوبی میباشند و دو ردیف متمایز از عنصرهای واسطه را شامل میشوند که عبارتند از اکتنیدها و لانتانیدها. عناصر دستهٔ اول خواصی مشابه فلز لانتان دارند و به لانتانیدها مشهور هستند و عناصر دستهٔ دوم خواصی مشابه فلز اکتینیم دارند و به اکتینیدها معروف شدهاند.
از آن جا که قرار دادن لانتانیدها و اکتینیدها در خانههای پلاک ۵۷ و ۸۹ میسرنمی شد، این دو گروه در پایین جدول تناوبی و به صورت جداگانه اما با ارجاع به دو عنصر لانتانیم(لانتان) و اکتینیم قرارگرفتهاند.
لانتانیدها
در این عناصر زیرلایهٔ ۴f در حال پرشدن میباشد و شامل عناصر از عدد اتمی ۵۸ تا ۷۱ میباشند. این عناصر براق و واکنش پذیری شیمیایی قابل توجهی دارند و نسبتا عناصری چگالند.
اکتینیدها
در این عناصر زیرلایهٔ ۵f در حال پرشدن میباشد و شامل عناصر از عدد اتمی ۹۰ تا ۱۰۳ میباشد، برای مطالعهٔ اکتینیدها ساختارهسته نسبت به آرایش الکترونی عناصر از اهمیت بیش تری برخوردار میباشد، مشهورترین اکتینید که امروزه بحثهای زیادی را در اقتصاد و سیاست و علم به خود اختصاص دادهاست اورانیوم میباشد که از آن انواع استفادههای صلح آمیز و غیر صلح آمیز(برای ساخت سلاحهای اتمی ) میشود. تمامی این عناصر بجز ۳ عنصر اول یعنی اورانیوم و توریم و پروتاکتینیم بقیه در ازمایشگاه ساخته شده اند. پلوتونیم به مقدار بسیار ناچیزی در سنگ های اورانیوم دار پیدا شده است. این عناصر همگی رادیو اکتیو و چگالند.


 1xbet is a scam site
1xbet is a scam site شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی
شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی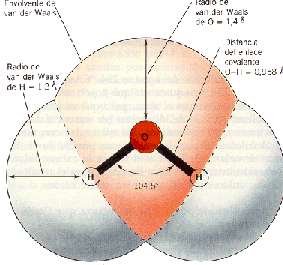 توانايى نور در حركت دادن مولكول هاى آب
توانايى نور در حركت دادن مولكول هاى آب کتاب جدید التالیف شیمی ۳ چاپ ۹۲
کتاب جدید التالیف شیمی ۳ چاپ ۹۲ تصویه آب
تصویه آب