اکتینید ها: عنصر های 90 تا 103 جدول تناوبی را تشکیل می دهند .که نام آن ها از فلز اکتینیم (89Ac) گرفته شده است.
در این عنصر ها اوربیتال 5f در حال پر شدن است. ساختار هسته در این عنصر ها نسبت به آرایش الکترونی از اهمیت بیش تری برخوردار است. همه ی اکتنید ها هسته ی ناپایداری دارند و به همین دلیل پرتوزا هستند. برای مثال :
مشهور ترین اکتینید ، اورانیم است که از فرو پاشی هسته ی آن انرژی لازم برای تولید برق در نیروگاه ها ، زیر دریایی ها و ناوهای هواپیما بر فراهم می شود. (اکتینید ها در گروه سوم و دوره ی هفتم جدول تناوبی قرار دارند.
اکتنيدها گروهي از عناصر شيميايي هستند که داراي خواص شيميايي مشابهي مي باشند . اين گروه پانزده عنصر شيميايي را از اکتينيوم (Ac) با عدد اتمي 89 تا لارنسيوم (Lr ) با عدداتمي 103 در بر مي گيرد . عناصر شيمييايي يک گروه در جدول تناوبي بايستي زير يکديگر نوشته شوند . اما به دليل تعداد زياد عناصر اين گروه ، توافق شده است که عناصر گروه اکتنيدها در زير جدول تناوبي وبه صورت يک رديف مستقل نوشته شونداکتنيدها نسبت به لانتانيدها داراي شباهت رفتاري کمتري هستند. اين گروه از عناصر طيف رفتاري گسترده تري را نسبت به در حالتهاي اکسايشي به نمايش مي گذارند و اين مسأله موجب مي شود که اين تصور پيش بيايد که آيا اکتينيوم، توريوم و اورانيوم بايستي به عنوان عناصري از بلوک d در نطظر گرفته شوند. تمامي عناصر موجود در خانواده ي اکتنيدها راديواکتيو هستند
.
اکتنيدها عمدتاً در زير بخش اصلي جدول تناوبي ( زير لانتانيدها) نوشته مي شوند . يکي از ترکيبات آلي فلزي اکتنيدها تحت عنوان «ارگانواکتنيد organoactinod» شناخته مي شود .
فراواني
فقط توريوم و اورانيوم به صورت طبيعي در پوسته ي زمين يافت مي شوند و مقدار آنها قابل توجه است . مقدار ساير عناصر بسيار بسيار ناچيز است و غالب آنها به صورت مصنوعي در آزمايشگاهها تهيه مي شوند و نيمه عمر بعضاً کوتاهي دارند. نپتونيوم و پلوتونيوم نيز در کانه هاي اورانيوم (سنگ معدن) و آن هم در نتيجه ي واپاشي اورانيوم وجود دارند . بقيه ي عناصر مربوط به گروه اکتنيدها – همانطور که گفته شد – به واسطه ي واکنشهاي هسته اي ساخته مي شوند .
تاريخچه
از نخستين عنصر مربوط به خانواده اکتنيدها ، يعني عنصر اکتينيوم با عدد اتمي 89 تا اورانيوم با عدد اتمي 92 که داراي شباهتهايي با فلزات واسطه مي باشند ، فرض بر آن بود که عناصر پس از اورانيوم داراي خصوصيات اينچنيني باشند.
یکي از محققان به نام «مانهاتان پروجکت Manhattan Project» در سال 1944 به همراه يکي ديگر از دانشمندان معاصر خود به نام گلِن ت. سيبورگدر هنگام جداسازي آمريسيوم و کوريم با مشکلات پيش بين نشده اي مواجه شدند. آنها باخود مي انديشيدند که ممکن است اين عناصر به دسته يا خانواده ي ديگري از عناصر جدول تناوبي تعلق داشته باشند . بنابر اين نتيجه گرفتند که با دسته ي جديدي از عناصر جدول تناوبي روبرو شده اند . سپس در سال 1945 و به رغم مخالفت بسياري از همکاران ، آنها سري اکتنيدها را در جدول مندليف که تا آن زمان تغييري نکرده بود ، وارد نمودند. در ادامه ، Seaborg طي مقاله اي اکتنيدها را به عنوان فلزاتي سنگين و با آرايش الکتروني پيچيده معرفي نمود و پيش بيني کرد که اکتنيدها يک دسته يا سري از فلزات واسطه را که شبيه به لانتانيدها باشند ، تشکيل مي دهند .
در سال 1961 يک دانشمند لهستاني به نام Antoni Przybylski ستاره اي را کشف کرد که بعدها معلوم شد اين ستاره داراي مقدار قابل توجهي از عناصر خانواده اکتنيدها مي باشد .اين ستاره HD 101065 نام دارد که البته به افتخار کاشف آن « پريزي بولسکي Przybylski » نيز ناميده مي شود .
سری فلزات اکتینید
در جدول تناوبی دو ردیف در پایین جدول وجود دارد. سری های لانتانید و اکتینید. سری لانتانید ها می توانند به طور طبیعی در خاک یافت شوند. فقط یک عنصر از این سری رادیواکتیو است. سری اکتینید خیلی فرق می کند. همه آنها رادیواکتیو هستند و تعدادی از آنها نیز در طبیعت یافت نمی شوند. بعضی از این عناصر، فقط در آزمایشگاه ها ایجاد شده اند
آشنایی با گروه
پانزده عنصر که با اکتینیوم (Ac) با عدد اتمی 89 شروع و با لارسنیوم(La) با عدد اتمی 103 پایان می یابند. معلمتان هرگز از شما نخواهد خواست که همه عناصر در این سری را حفظ کنید، فقط اکتینیوم را به خاطر بسپارید.
اكتنيدها
دورة هفتم از جدول كه هنوز تكميل نيافته با فلز راديو اكتيو فرانسيم(عنصر فرانسيم به مقدار بسيار ناچيز هم در زنجيره تباهي و تجزيه هستهاي مواد راديواكتيو طبيعي وجود دارد و هم در واكنشهاي هستهاي بوجود ميآيد.) در خانه 87 آغاز ميگردد. سه عنصر اوليه و راديو اكتيو اين دوره بلند يعني فرانسيم، راديم و اكتينيم به ترتيب داراي آرايشهاي سطح ظرفيتيو بوده كه نظير آرايش سه عنصر اوليه دورة قبلي يعنيوميباشد. انتظار ما اين است كه ساختمان الكتروني عناصر بعد از اكتينيم مشابه عناصر دوره قبلي باشد كه به پيدايش 14 عنصر لانتانيد مانند انجاميد. به عبارت ديگر، در لانتانيدها چهارده الكترون متوالياً وارد اوربيتالهايشدند، و در اينجا نيز اين توقع را داريم كه آنها متوالياً واردشوند.
متأسفانه حدس علمي ما درست از آب در نميآيد. زيرا نياز به اطلاعات بيشتري داريم. در دوره ششم وضع روشنتر بود . تـرازضمن اينكه نزديـكبود ولي در اغلب جاها قاطعانه پايينتر از آن بود. در دوره هفتم، ترازهاي انرژيبه اندازهاي به يكديگر نزديك ميشوند كه توازن ميان آن دو يادآور عمليات بندبازي است! كوچكترين تغيير در شرايط، به نفع يك طرف و به ضرر ديگري تمام ميشود، در نتيجه الكترونها گاهي درو زماني دروارد ميگردند. در مواردي از قبيل در خانه 91، چنان توازني بر قرار ميشود كه نميتوان به دقت گفت كه آرايش حالت پايه اين عنصر ،،و يا است! شايد بتوان گفت كه در نيمه دوم اين سري جديد معروف به اكتينيدها، تراز انرژي اغلب، پايينتر از است. (نوسانات و آرايشهاي غير قابل پيش بيني عناصر اين دوره) با وجود اينها ميتوان گفت كه روند كلي تغييرات اكتينيدها و لانتانيدها، كم و بيش مشابه است.
لورنسيمكه آرايش را دارد، آخرين عنصر اكتينيد است. انتظار ميرود عناصري كه اخيراً كشف شده مانند عنصر شمارة 104 معروف به كورچاتوويم و عنصر 105 معروف به هانيم ، به علت ورود متوالي آخرين الكترونهاي آنها در، به تدريج چهارمين سري عناصر واسطه جدول تناوبي را تشكيل دهند.
هرگاه نمودارهايرا مقايسه كنيم، به نتيجة جالبي مي رسيم. شيب نزولي تراز اوربيتالهايخيلي كمتر ازاست. علت را بايد در كاهش شديد قابليت نفوذ آنها نسبت به رقيبان خود يعني اوربيتالهاي جستجو كرد. مسئله ديگر اين است كه در روندي مشابه روند قبلي، ديده ميشود كه اوربيتالهايو اوربيتالهاي توانايي نفوذ خوبي به سوي خارج يعني در جهت اوربيتال ندارند. از اينرو و با اين در هم آميختن با اوربيتالهاي دروني، به پايداري بيشتري ميرسند. به عبارت ديگر، تراز انرژي آنها نسبت به اوربيتال ، پايينتر است و الكترونها در آنها وارد ميشوند.






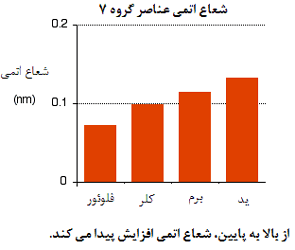

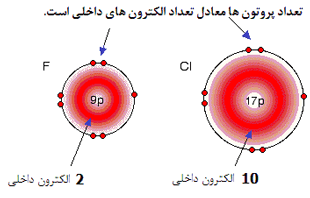
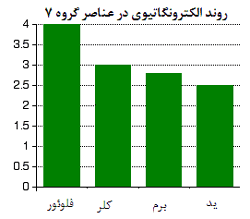
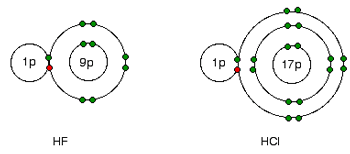


 1xbet is a scam site
1xbet is a scam site شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی
شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی