شعاع اتمی و یونی
همانطورکه میدانید/بیشتر فضای اتم خالی است.در واقع الکترون هادر محدوده هایی حرکت میکنند که شبیه به ابر به نظر میرسند.
بااین تشبیه می توان تصور کرد که تا چه اندازه/اندازه گیریابعاداتم ها دشوار است/زیرا مرزهای یک توده ابر مانند/نامشخص ومتغیر است.اندازه یک اتم به وسیله شعاع آن تعیین میشود.شعاع کووالانسی و واندروالسی دو نوع شعاع اتمی هستند.روش های تعیین شعاع اتمی عبارت اند از:
شعاع کووالانسی{Rc }
به نصف فاصله بین هسته ای دو اتم مشابه در یک مولکول دو اتمی هم نام/شعاع کووالانسی می گویند.واحد شعاع کووالانسی pm است.{pm=10m1}
در مولکول های تک اتمی مانند گازهای نجیب که اتم ها با یکدیگر پیوند کووالانسی نمی دهند/برای تعیین شعاع اتمی به جای شعاع کووالانسیباید شعاع واندر واندروالسی را اندازه گیری نمود.
شعاع واندروالسی{Rw}
به نصف فاصله بین هسته ای دو اتم مجاور مشابه از دو مولکول مجاور/شعاع واندروالسی میگویند.واحد شعاع واندروالسی pm است.{pm=101}
در مورد یک عنصر/همواره شعاع واندروالسی بزرگتر از شعاع کووالانسی است.
روند تغییر شعاع اتمی در یک گروه:
شعاع اتمی عنصر ها در هر گروه از جدول تناوبی از بالا به پایین به دو دلیل/افزایش میابد:
*از بالا به پایین در یک گروه جدول /به ازای هر تناوب یک لایه الکترونی جدید به تعداد لایه های الکترونی عنصر ها افزوده میشود.با زیاد شدن تعداد لایه های الکترونی/شعاع اتمی نیز افزایش میابد.به عبارت دیگر الکترون ها در فاصله دورتری نسبت به هسته قرار می گیرند.
*دلیل دیگر برای افزایش شعاع اتمی این است که با افزایش عدد اتمی در یک گروه/تعداد اربیتال های پرشده بین هسته و لایه های الکترونی بیرونی اتم افزایش میابد.وجود الکترون ها در اربیتال های درونی و اثرپوششی آنها بر الکترون های بیرونی/باعث افزایش فاصله الکترون های بیرونی از هسته یا به عبارتی افزایش شعاع اتمی میشود.
*بسیاری از دانش آموزان به اشتباه فکر می کنند که دلیل افزایش شعاع اتمی در یک گروه از بالا به پایین/کاهش بار موثر هسته برالکترون های ظرفیت است.ولی همانطور که در مبحث مربوط به بار{بار موثر هسته} گفته شد/در یک گروه از بالا به پایین/بار موثر هسته افزایش میابد.
توجه داشته باشید که در اعیین فاصله الکترون های بیرونی از هسته اتم و به عبارت دیگر شعاع اتمی/علاوه بر بار موثر هسته/میزان دافعه الکترون های بیرونی با الکترون های درونی نیز تاثیر دارد.به طورکلی می توان گفت مهم ترین عامل در افزایش شعاع اتمی در یک گروه از بالا به پایین/افزایش تعداد لایه های اصلی الکترونی است.
| عنوان | پاسخ | بازدید | توسط |
| |
1 | 130 | alireza663 |
| |
8 | 5010 | mina |
| |
0 | 2432 | alex |
| |
0 | 2808 | alex |
| |
0 | 1292 | hesam |
| |
0 | 1546 | hesam |
| |
0 | 1279 | hesam |
| |
0 | 2342 | hesam |
| |
0 | 1286 | hesam |
| |
0 | 1549 | hesam |



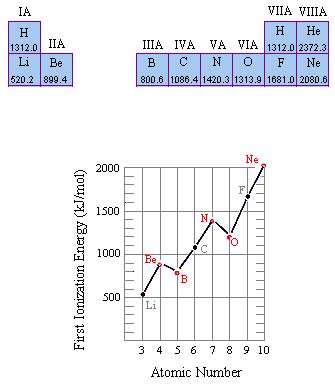
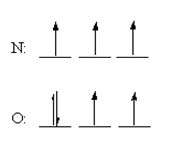
 1xbet is a scam site
1xbet is a scam site شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی
شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی