به نام خدا نام و نام خانوادگی:ماهان رهنما.
نام دبیر:آقای سلامی.
کلاس:06(سال اول).
دبیرستان:ملاصدرا(1).
اصطلاح شیمی سبز در
این قانون همچنین راهی برای اجرای اقدامـاتی فراتـر از آنـچه توسط برنامههای سازمان محافظت از محیط زیسـت EPA ایالـت متحده انجام میشود و برنامهریزی استراتژیهای خلاقانه برای محافظت از سلامتی انسانها و محیط زیست فراهم کرد. طبق این قانون، کاهش آلودگی در منشاء «اساساً متفاوت و مطلوبتر از مدیریت زباله و کنترل آلودگی است».
پس از تصویب این قانون، ادارهی جلوگیری از آلودگی و مواد سمی آژانس محافظت از محیط زیست OPPT ایده ایجاد یا بهبود محصولات و فرآیندهای شیمیایی جهت کاهش خطرات آنها در دست بررسی قرار داد. در سال 1991، OPPT یک برنامه آزمایشی را آغاز کرد. طبق این برنامه، برای اولین بار، کمک مالی به پروژههای تحقیقاتی مربوط به جلوگیری از آلودگی در تولید مصنوعات شیمیایی عرضه شد. از آن زمان تا کنون، برنامهی شیمی سبز سازمان محافظت از محیط زیست با دانشگاهها، صنایع، دیگر آژانسهای دولتی و سازمانهای غیردولتی همکاری نزدیکی برای جلوگیری از آلودگی از طریق اجرای شیمی سبز ایجاد کرده است.
طرز کار شیمی سبز
کارخانجات شیمیایی محل تولید مواد ارزشمند بسیار زیادی هستند. این مواد شامل آنتیبیوتیکها و داروهای دیگر، مواد پلاستیکی، بنزین و مواد سوختنی دیگر، مواد کشاورزی شیمیایی مانند کودها و سمهای شیمیایی، پارچههای نایلونی، ابریشم مصنوعی و پلیاسترها میباشد. این تولیدات با ارزش هستند ولی برخی از این مواد و فرآیندهای شیمیاییای که برای ساخت آنها استفاده میشود. به محیط زیست و سلامت انسانها صدمه میزند. هدف شیمی سبز این است که آلودگی را از طریق جلوگیری از ایجاد آن، در وهلهی اول، کاهش دهد.
طبق اصول این رشته، در طراحی یک واکنش شیمیایی، شیمیدانها پیش از استفاده از یک مادهی شیمیایی یا تولید محصولات مرتبط با آن توجه زیادی به دانشی که در مورد خطرات احتمالی یک مادهی شیمیایی برای سلامتی انسان و محیط زیست داریم، میکنند. به بیان دیگر، آنها خطری را که یکی از خواص ماده ایجاد میکند. که میبایست علاوه بر دیگر خواص شیمیایی و فیزیکی ماده مورد توجه قـرار گیـرد، را مـورد بـررسی قرار میدهند، و موادی را انتخاب میکنند که این خطر را به حداقل رساند.
در کتاب سال 1998، شیمی سبز، نظریه و عمل (نشر دانشگاه آکسفورد) (1)، پل اناستاس و جان وارنر 12 اصل ارایه کردن که روشهای به اجر گذاشتن شیمی سبز را در اختیار شیمیدانها قرار میدهد. چهار اصل از این اصول در زیر آمده است.
- با در نظر گرفتن بیخطر بودن کار را شروع کنید:واکنشهایی را که از مواد بیخطر برای تولید محصول مورد نیاز استفاده میکنند، مورد توجه قرار دهید.
این روش با به حداقل رسانیدن خطر به کارگران کارخانه به هنگامی که با این مواد سرو کار دارند میشوند و از انتشار اتفاقی مواد شیمیایی خطرناک از راه خطرناک از راه نشست یا انفجار جلوگیری میکند. برای مثال، این اصل در روش جدیدی که جهت تولید یک مادهی مهم شیمیایی صنعتی، اسید آدیپتیک، استفاده میشود، به کار گرفته شده است. نزدیک به دو میلیارد کیلوگرم اسید آدیپیک در سال برای ساخت نایلون، پلییورتن، مواد روغنی و گریس و نرم کنندهها مورد نیاز است. در روش متداول ساخـت اسیدآدیپیک از بنزن، که میتواند باعث سرطان شود، به عنوان ماده راه انداز واکنش استفاده میشود. در پروژهای که جدیداً ایجاد شده، که از باکتریهای که از نظر ژنتیکی تغییر یافتهاند ـ به نام کاتالیزورهای حیاتی ـ استفاده میشود، قند سادهی گلوکز جانشین بنزن شده است.
راه اندازی واکنش با ماده بیخطری ماننـد گلوکز بـرای ساخـت اسید آدیپیک یعنی این که، اگر استفاده از فرآیندهای مشابه به این فرآیند گسترش یابد، میتوان از به کار بردن مقادیر بسیار زیاد مواد شیمیایی خطرناک اجتناب کرد.
- از منابع تجدید شدنی استفاده شود: تاکید بیشتری بر به کار بردن مواد راهانداز تجدید شدنی، مانند موادی که از گیاهان رستنی به دست میآیند، به جای استفاده از موادی چون نفت خام و گاز طبیعی شود.
گلوکزی که در مثال فوق به عنوان ماده راه انداز ذکر شد میتواند از نشاسته ذرت یا سلولزی که در گیاهان وجود دارد، به دست آید. حتی از چوب، ساقه، برگهای ریخته شده ذرت نیز میتوان گلوکز به دست آورد. در یک مثال دیگر، میتوان از نشاسته ذرت برای تولید گلولههای کوچک پفی مخصوص بستهبندی کالا استفاده کـرد. این لـولههای کـوچک پفـی میتواند جایگزین مواد بستهبندی پلاستیکیای شوند که از مواد شیمیایی مشتق شده از نفت خام به دست میآیند.
- حلالهای بیخطر پیدا کنید:استفاده از حلالهای سمی برای حل کردن موادی که در واکنش شیمیایی به کار برده میشوند، را حذف کنید.
حلالها موادی شیمیایی هستند که مواد دیگر را در خود حل میکنند. بسیاری از حلالها که در مقادیر زیاد در صنعت به کار برده میشوند برای سلامت انسان مضر هستند یا میتوانند خطرات دیگری مانند آتشسوزی و انفجار به وجد آورند. حلالهایی که به طور گسترده استفاده میشوند و برای سلامت انسان مضر باشند شامل تتراکلرید کربن، کلروفرم، پرکلر و اتیلن هستند.
برخی مواقع امکان جایگزین کردن حلالها با مواد کمخطرتر مثل آب یا دیاکسیدکربن مایع وجود دارد. برای مثال، فرآیندهای جدیدی برای خشکشویی لباسها به تازگی ایجاد شدهاند که با استفاده از دیاکسید کربن، مایع به جای مادهی شیمیایی سمی پرکلر و اتیلن، لک چربی و چرک را حل کنند.
- در اسـتفاده از اتـمها صـرفـهجویی کنید:واکنشهایی را طراحی کنید که در آنها از اکثر یا تمامی اتمهایی که با آنها واکنش را شروع کردهاید در محصول نهایی استفاده شود، نه این که تبدیل به محصولات جانبی دور ریختنی و زباله شوند.
بوی تراست، شیمیدان دانشگاه استانفورد، مفهوم فوق را ارایه کرد، که وی نام آن را صرفهجویی در اتمها گذاشته است. یکی از مثالهایی که برای این اصل میتوان نام برد فرآیند بهبود یافتهای است که در سال 1991 برای ساخت داروی مسکن ایبوبروفن ـ عنصر فعال استفاده شده در داروهایی با عناوین تجاریای چون موترین، ادویل، نوپرین، مدیپرن ـ طراحی شد.
در فرآیند اولیه شش مرحلهای که در سال 1960 به وجود آمد، 40% اتمها به صورت محصول نهایی (ایبوبروفن) درمیآمدند و 60% اتمها به صورت محصولات جانبی ناخواسته یا زباله درمیآمدند. فرآیند جدید بری تراست سه مرحله دارد و 77% اتمهای واکنش کننده به صورت محصول نهایی، ایبوبروفن، درمیآیند. این فرآیند سبز باعث حذف صدها هزار کیلوگرم محصولات جانبی شیمیایی در سال شده است و مقدار اتمهای واکنش کننده که برای ساخت ایبوبروفن به کار میروند، را به میزان صدها هزار کیلوگرم در سال کاهش داده است.
توجه به این اصول به محیط زیست کمک میکند و میتواند در بلد مدت پول زیادی برای شرکتها از طریق، کاهش هزینه کنترل آلودگی و استفادهی کمتر از انرژی، صرفهجویی کند.
نگاهی به اصل های دوازده گانه شیمی سبز
واژه شیمی، اغلب با كلماتی نظیر محصولات، صنعت، شغل، تجارت، پیشرفت و خطرات همراهاست. صنایع شیمیایی برای افراد زیادی اشتغال ایجاد كرده اند. بنابراین در حیاتاجتماعی و اقتصادی جوامع نقش كلیدی دارند. از سوی دیگر بسیاری از فرایندهایی كه ازمواد شیمیایی استفاده می كنند می توانند اثرهای زیان آوری روی محیط زیست یا سلامتیانسان داشته باشند. بنابراین حذف یا كاهش این خطرات تا یك سطح قابل قبول، مسئله ایبسیار مهم است. خطرهای مواد شیمیایی را می توان با رابطه زیر نشان داد: انتشار * زیان آوری = خطر
با توجه به رابطه بالا با كاهش انتشار مواد خطرناك می توان ازخطرهای احتمالی مواد شیمیایی كاست. این كار معمولاً با اعمال محدودیت های قانونی درمراحل استفاده، جابه جایی، تصفیه و یا دفع مواد شیمیایی انجام می شود. اما شیمی سبزبه پارامتر اول یعنی زیان آوری مواد شیمیایی می پردازد و به دنبال این است كه خطرذاتی مواد را كاهش دهد. شیمی سبز بنابر پذیرفته ترین تعریف آن عبارت است از: طراحی،توسعه و به كارگیری فرایندها و محصولات برای كاهش یا حذف موادی كه برای انسان یامحیط زیست خطرناك هستند. برای شیمی سبز ۱۲ اصل بیان می كنند كه عبارتند از:
۱ _ بهتر است كه مواد زاید در فرایندها تولید نشوند تا اینكه به فكر راهی برای از بینبردن آنها باشیم.
۲ _ روش های ساخت مواد باید به گونه ای طراحی شوند كه بیشتریناستفاده از مواد واكنش دهنده انجام شود و تمامی آنان به محصول تبدیل شوند.
۳ _ تا آنجا كه امكان پذیر است روش های ساخت مواد به گونه ای طراحی شود كه خطری رامتوجه انسان یا محیط زیست نكند.
۴ _ محصولات جدید باید به گونه ای طراحی شوندكه بیشترین كارایی همراه با كمترین میزان سمیت را داشته باشند.
۵ _ استفاده ازمواد كمكی مانند حلال ها و... به كمترین میزان ممكن برسد و در شرایط اضطرار هم ازمواد كم خطرتر استفاده شود.
۶ _ انرژی مورد نیاز فرایندها با توجه به شرایطاقتصادی و محیطی فراهم شود و تا آنجا كه ممكن است فرایندهای شیمیایی در دما و فشارمعمولی انجام شوند.
۷ _ از مواد خامی استفاده شود كه قابلیت تولید مجدد درطبیعت را داشته باشند. (منابع تجدیدشونده)
۸ _ تا آنجا كه امكان پذیر است مراحلفیزیكی و شیمیایی واكنش ها كوتاه شود.
۹ _ از واكنشگرهای كاتالیزوری به جایواكنشگرهای استوكیومتری استفاده شود.
۱۰ _ سعی شود محصولات فرایندهای شیمیاییبه صورت زیست تخریب پذیر باشند.
۱۱ _ روش های تجزیه ای برای كنترل لحظه به لحظهواكنش های شیمیایی طراحی و توسعه داده شوند تا بتوان در هر لحظه تولید مواد مضر راتشخیص داد.
۱۲ _ از مواد یا حالتی از مواد استفاده شود كه كمترین قابلیت برایایجاد حوادثی مانند نشت، انفجار و آتش سوزی را داشته باشد. هم اینك نزدیك به پانزدهسال از تلاش های جدی شیمیدانان برای استفاده از اصول شیمی سبز می گذرد و در همینمدت كارهای ارزنده ای به انجام رسیده است. این تلاش های علمی را می توان در ۳ محورزیر خلاصه كرد.
الف _ استفاده از مواد اولیه جایگزین: این راهكار در صنایعطرفداران بسیاری پیدا كرده است. یكی از اقداماتی كه انجام شده استفاده از مواد زایدیك فرایند به عنوان ماده اولیه برای فرایند دیگر است. اقدام دیگر استفاده از منابعتجدید شونده مثل استفاده از اسید لاكتیك حاصل از مواد طبیعی تجدیدشونده برای ساختنبعضی از پلیمرها به جای استفاده مواد حاصل از نفت خام است. اما ساده ترین و ارزانترین ماده اولیه كه برای ساختن بسیاری از مواد آلی از آن می توان استفاده كرد، دیاكسیدكربن (co۲) است. با این كار نه تنها استفاده از نفت خام كمتر می شود بلكه ازانتشار بیش از حد گاز دی اكسیدكربن در جو نیز جلوگیری می شود. مشكل اساسی دراستفاده از دی اكسیدكربن پایداری ترمودینامیكی بالای آن و فعالیت شیمیایی كم آناست، هم اینك از دی اكسیدكربن در ساختن بعضی از پلیمرها و نیز اسیدفرمیك استفاده میشود.
ب _ استفاده از حلال های جایگزین: حلال های آلی با توجه به استفاده زیاداز آنها، اصلی ترین منابع آلودگی های شیمیایی هستند و كنترل موثر آنها می تواندپیشرفت های اساسی در مسائل زیست محیطی به همراه داشته باشد. بهترین راه برای خلاصشدن از مشكلاتی كه حلال ها به همراه دارند، استفاده نكردن از آنها است، كه هم اینكتوسط بعضی از صنایع رنگ سازی و صنایع پوششی در حال انجام است. واكنش هایی كه درشرایط بدون حلال انجام شده است در بیشتر موارد بهتر و سریع تر از روش های معمولبوده است. از مهمترین سیستم های حلالی جایگزین می توان سیال های فوق بحرانی، مایعاتیونی و آب را نام برد.
ج _ روش های سنتزی جایگزین: هر جا كه از سیستم هایكاتالیزوری برای تهیه مواد استفاده شده، شرایط بهتری برای تولید مواد فراهم شدهاست. هر چند كه یك قرن پیش استفاده زیادی از كاتالیزورها در صنعت نمی شد، اما امروزهیچ شركت شیمیایی نمی تواند بدون استفاده از كاتالیزورها در بازار رقابت دوامبیاورد. اخیراً روشی جدید برای سنتزایبوبروفن ارائه شده است كه نسبت به روش قبلیچند مرحله كوتاه تر شده و همچنین حلال سمی تتراكلریدكربن هم از مراحل آن حذف شدهاست. شركت دارویی فایزر هم با استفاده از اصول شیمی سبز روش تهیه جزء اصلی یكی ازداروهای ضدافسردگی خود را بهبود بخشیده است. در ادامه خوب است نگاهی هم به وضعیتشیمی سبز در ایران داشته باشیم. در ۷ سال گذشته توجه به شیمی سبز در محافل دانشگاهیاهمیتی روزافزون یافته است به طوری كه در سال های اخیر نزدیك به ۳۰ درصد مقالاتشیمی كشور به نحوی با شیمی سبز ارتباط داشته است. اما متاسفانه این رویكرد نسبت بهشیمی سبز در ایران بیشتر رویكردی سطحی بوده و همچنان در سطح مانده است. شاهد بندهدر این مدعا آشنا نبودن اكثر دانشجویان مقاطع مختلف شیمی با اصول ایمنی و میزانزیان آوری مواد شیمیایی و نیز رعایت نشدن بیشتر اصول ایمنی، در آزمایشگاه های شیمیكشور است. در بسیاری از موارد می بینیم كه مقالاتی با عنوان شیمی سبز از سوی افرادو مراكز تحقیقاتی منتشر می شود كه آن مراكز از حداقل امكانات ایمنی برای انجام سادهترین واكنش های شیمیایی برخوردار نیستند. در صنایع كشور ما دیگر چیزی به نام شیمیسبز نداریم و بهتر است گفته شود كه در صنایع نه تنها به كم كردن خطر ذاتی موادشیمیایی توجهی نمی شود، بلكه در بیشتر موارد هیچ محدودیت قانونی و اخلاقی در تخلیهو دفع مواد زاید شیمیایی وجود ندارد، هر چند كه به ظاهر بیشتر این صنایع موفق بهاخذ استانداردهای زیست محیطی شده اند. بسیاری از خوانندگان محترم به یاد دارند كهسال گذشته از چاه های آب اطراف پالایشگاه تهران مواد نفتی بیرون می آمد و البته كسیهم پاسخگو نبود. بیشتر پساب های صنعتی كشور نیز وضعیتی اینگونه دارند و به راحتیوارد آب های جاری و یا زیرزمینی می شوند. از سوی دیگر بیشتر صنایع ما را صنایعوابسته به نفت تشكیل می دهند كه از آلوده كننده ترینصنایع محسوب می شوند. حد قابلقبول برای تولید مواد زاید در این صنایع ۱۰/۱ درصد كل تولید است حال اگر صنایع مابا این فناوری موجود بتواند به این حد قابل قبول برسد - كه البته محال به نظر میرسد _ باز هم سالانه میلیون ها تن مواد زاید به همراه مواد غیرزاید نفتی تولید میشود كه چگونگی دفع یا احیاناً تصفیه این مواد بر ما پوشیده است. تولید مواد زایدسمی در صنایع فلزی نیز كه قسمت عمده صنایع غیرنفتی كشور ما را تشكیل می دهند، بسیارزیاد است.













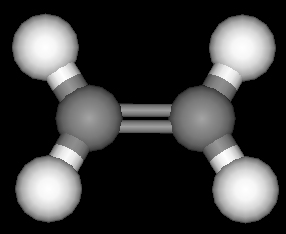
 پروپن
پروپن ۲ - بوتن
۲ - بوتن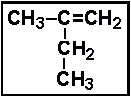 ۲ - متيل ۱- بوتن
۲ - متيل ۱- بوتن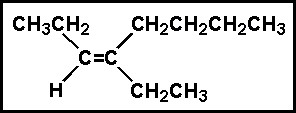
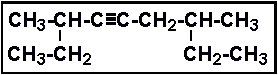 ۳ و۷ دي متيل ۴ - نونين
۳ و۷ دي متيل ۴ - نونين

 1xbet is a scam site
1xbet is a scam site