موضوع تحقیق : جدول تناوبی
نام و نام خانوادگي :
مجتبی کریمی
كلاس:
04
نام دبير :
آقای سلامی
سال تحصیلی 92-91
دبیرستان ملاصدرا
جدول تناوبی عناصر
جدول تناوبی عنصرهای شیمیایی، نمایش جدولی عنصرهای شیمیایی بر پایهٔ عدد اتمی، آرایش الکترونی و ویژگیهای شیمیایی آنها است. ترتیب جایگیری عنصرها در این جدول از عدد اتمی کمتر به سوی عدد اتمی (شمار پروتونهای) بالاتر است. شکل استاندارد این جدول ۱۸ × ۷ است؛ عنصرهای اصلی در بالا و دو ردیف کوچکتر از عنصرها در پایین جای دارد. میتوان این جدول را به چهار مستطیل شکست، این چهار ستون مستطیلی عبارتند از:............
بلوک اس در سمت چپ، بلوک پی در راست، بلوک دی در وسط و بلوک اف یا همان فلزات واسطهٔ خارجی در پایین. ردیفهای این جدول، دوره و ستونهای آن یا همان ستونهای s و d و p، گروههای جدول تناوبی نام دارند. همچنین گاهی برخی از این گروههای نامهای ویژهای دارند برای نمونه گروه هالوژنها و گازهای نجیب از آن جملهاند. هدف از ساخت جدول تناوبی چه به شکل مستطیلی و چه به شکلهای دیگر برای بررسی بهتر ویژگیهای شیمیایی عنصرها بوده است این جدول کاربرد زیادی در دانش شیمی و پردازش رفتار عنصرها دارد.
اعتبار جدول تناوبی به پای دیمیتری مندلیف نوشته شده است با اینکه پیشروان دیگری پیش از او وجود داشتهاند. او این جدول را در سال ۱۸۶۹ منتشر کرد این نخستین جدولی بود که به این گستردگی مرتب شده بود. مندلیف این جدول را درست کرد تا ویژگیهای دورهای آنچه که بعدها «عنصر» نام گرفت را بهتر نشان دهد. وی توانسته بود برخی ویژگیهای عنصرهایی که هنوز کشف نشده بود را پیشبینی کند و جای آنها را خالی گذاشته بود. کم کم با پیشرفت دانش، عنصرهای تازه تری شناسایی شد و جای خالی عنصرها در جدول پُر شد. با شناسایی عنصرهای نو و گسترش شبیه سازیهای نظری دربارهٔ رفتار شیمیایی مواد، جدول آن روز مندلیف بسیار گستده تر شده است.
همهٔ عنصرهای شیمیایی از عدد اتمی ۱ (هیدروژن) تا ۱۱۸ (آناناکتیوم) شناسایی یا ساخته شدهاند. از ابتدای جدول تا کالیفرنیم (و خود کالیفرنیم) همهٔ عنصرها در طبیعت پیدا میشوند اما باقی ماندهٔ آنها در آزمایشگاه ساخته شدهاند. دانشمندان هنوز به دنبال ساخت عنصرهای پس از آناناکتیوم اند و البته این پرسش را پیشرو دارند که عنصرهای تازه تر چگونه جدول را اصلاح خواهند کرد. همچنین ایزوتوپهای پرتوزای بسیاری هم در آزمایشگاه ساخته شده است.
ظاهر
همهٔ نسخههای جدول تناوبی تنها دربردارندهٔ عنصرهای شیمیایی اند و مخلوط، ترکیب یا ذرات زیراتمی در آنها جایی ندارد.[n ۱] هر عنصر شیمیایی یک عدد اتمی یکتا دارد و این عدد برابر با شُمار پروتونها در هستهٔ اتمش است. عنصرها میتوانند در اتمهای گوناگون شُمار نوترونهای متفاوت داشته باشند در این حالت به آنها ایزوتوپ گفته میشود. برای نمونه کربن سه ایزوتوپ طبیعی دارد همهٔ ایزوتوپهای کربن ۶ پروتون، و بیشتر آنها ۶ نوترون دارند اما یک درصد آنها ۷ نوترون و شمار کمتری از آنها ۸ نوترون دارد. ایزوتوپها هرگز در جدول تناوبی به صورت از هم جدا، نمایش داده نمیشوند بلکه به صورت دستهای با هم زیر عنصر میآیند. عنصرهایی که هیچ ایزوتوپ پایداری ندارند جرم اتمی پایدارترین ایزوتوپشان را خواهند داشت و جرمهای اتمی آنها درون پرانتز فهرست میشود.[۱]
در جدول تناوبی استاندارد عنصرها به ترتیب عدد اتمی (شمار پروتونها در هسته) کمتر به بیشتر مرتب شدهاند. یک ردیف تازه در جدول (دورهٔ جدول تناوبی) با یک لایهٔ الکترونی تازه و نخستین الکترونش آغاز میشود. عنصرهایی که در یک ستون جدول (گروه) جای میگیرند همگی شمار الکترونهای برابر در لایهٔ آخر الکترونی خود دارند به عبارت دیگر آرایش الکترونی لایه آخر آنها یکسان است مانند اکسیژن و سلنیم که هر دو در یک ستون اند و هر دو چهار الکترون در لایهٔ بیرونی آرایش الکترونی خود یعنی تراز P، دارند. عنصرهایی که ویژگیهای شیمیایی همانندی دارند معمولا در یک گروه جدول میافتند. هرچند گاهی استثنا هم دیده میشود برای نمونه در بلوک f و از برخی نظرها در بلوک d عنصرهایی که در یک دوره اند ویژگیهای نزدیک به هم از خود نشان میدهند. در نتیجه به آسانی میتوان ویژگیهای شیمیایی یک عنصر را با آگاهی از عنصرهای پیرامونی اش پیش بینی کرد.[۲]
تا سال ۲۰۱۲ جدول تناوبی ۱۱۸ عنصر داشته است که ۱۱۴ تا از آنها به صورت رسمی از سوی اتحادیه بینالمللی شیمی محض و کاربردی پذیرفته و نامگذاری شدهاند. ۹۸ عنصر از ۱۱۸ تا به صورت طبیعی پدید آمدهاند و از آن میان ۸۴ مورد از روز پدیداری زمین ثابت بودهاند در حالی که ۱۴ تای باقی مانده در زنجیرهٔ نیمهعمر افتادهاند یا به عبارت دیگر پرتوزایند.[۳] همهٔ عنصرهای میان اینشتینیم و کوپرنیسیم و همچنین دو عنصر فلروویوم و لیورموریوم در طبیعت پدید نیامدهاند بلکه در آزمایشگاه ساخته شدهاند سپس آیوپاک آنها را به طور رسمی پذیرفته است. گزارش شده که عنصرهای ۱۱۳، ۱۱۷، ۱۱۵ و ۱۱۸ هم در آزمایشگاه ساخته شدهاند اما هنوز آیوپاک آنها را تایید نکرده است. برای همین این عنصرها هنوز با نام ترکیب شیمیایی و بر پایهٔ عدد اتمیشان شناخته میشوند.[۴] تاکنون عنصری سنگینتر از اینشتینیم (عنصر ۹۹) در طبیعت به صورت خالص در اندازهٔ قابل مشاهده، پیدا نشده است.[۵] از سال ۲۰۱۲ هنوز عنصری که ۱۱۸ را رد کند ساخته نشده است.[۶]
روش دستهبندی
گروه
نوشتار اصلی: گروههای جدول تناوبی
یک گروه یا خانواده یک ستون عمودی از جدول تناوبی است. عنصرهای یک گروه معمولا ویژگیهای نزدیک به هم بیشتری دارند تا عنصرهای یک دوره یا بلوک. دانش مکانیک کوانتوم نشان میدهد که دربارهٔ ساختار اتمی پژوهش میکند نشان میدهد که چون عنصرهای موجود در یک گروه همگی از آرایش الکترونی یکسانی در لایهٔ آخر الکترونی برخوردارند[۷] برای همین ویژگیهای شیمیایی همانندی از خود نشان میدهند و هرچه عدد اتمی آنها بالاتر میرود ویژگیهایشان بیشتر نمود پیدا میکند.[۸] با این حال گاهی در بلوک d و f همانندیهای عنصرهای یک دوره به اندازهٔ همانندیها در یک گروه مهم اند. به همانندی (شباهت) در یک دوره، همانندی افقی و در یک گروه، همانندی عمودی می گوییم.[۹][۱۰][۱۱]
بر اساس یک قرارداد جهانی، گروهها از ۱ تا ۱۸ شمارهگذاری شدهاند که گروه شمارهٔ یک را نخستین گروه از چپ (فلزهای قلیایی) و آخرین گروه را گروه نخست از راست (گازهای نجیب) در نظر گرفتهاند.[۱۲] در گذشته شمارهٔ گروهها را با عددهای رومی نشان میدادند. همچنین در آمریکا برای گروههای بلوک اس و پی یک حرف A و برای عنصرهای بلوک دی یک حرف B در کنار شمارهٔ رومی گروه میگذاشتند. برای نمونه برای نشان دادن گروه چهار مینوشتند: IVB و برای گروه چهاردهم یا عنصرهای گروه کربن مینوشتند.IVA در اروپا هم همین روش بکار میآمد با این تفاوت که حرف A برای گروههای پیش از گروه ۱۰ و حرف B برای عنصرهای گروه ۱۰ و گروههای پس از آن بکار میرفت. در سال ۱۹۸۸ آیوپاک سامانهٔ نامگذاری تازهای را پیشنهاد کرد و روشهای پیشین همگی فراموش شد.[۱۳]
|
نامگذاری نخستین گروهها |
|
|
1 |
|
|
2 |
|
|
11 |
|
|
12 |
فلزهای فرار (کم کاربرد) |
|
13 |
|
|
14 |
|
|
15 |
|
|
16 |
|
|
17 |
|
|
18 |
|
عنصرهای یک گروه در شعاع اتمی، انرژی یونش و الکتروندوستی به هم مانند اند. از بالا به پایین، شعاع اتمی عنصرها افزایش مییابد در نتیجه الکترونهای لایهٔ آخر در فاصلهٔ دورتری از هسته جای میگیرند چون ترازهای انرژی بیشتری پُر شدهاند. از بالا به پایین، انرژی یونش کاهش مییابد چون الکترونها کمتر به هسته پیوند خوردهاند و آسان تر میتوان آنها را جدا کرد. با تحلیل مشابه، از بالا به پایین الکتروندوستی عنصرها کاهش مییابد چون فاصلهٔ میان الکترونهای لایهٔ آخر و هسته افزایش مییابد.[۱۴] البته در این میان استثناهایی هم وجود دارد. برای نمونه در گروه ۱۱ الکتروندوستی از بالا به پایین افزایش مییابد.[۱۵]
دوره
نوشتار اصلی: دوره (جدول تناوبی)
یک دوره در جدول تناوبی، یک ردیف افقی از این جدول است. با اینکه عنصرها در یک گروه همانندیهای بسیاری دارند اما بخشهایی از دورهها هستند که از اهمیتی بیش از گروهها برخوردارند. مانند بلوک اف، جایی که لانتانیدها و آکتینیدها دو مجموعهٔ افقی از عنصرهای جدول را میسازند.[۱۶]
عنصرها در یک دوره همانندیهایی از دید شعاع اتمی، انرژی یونی شدن، الکتروندوستی و Electron affinity (مقدار انرژی آزاد شده هنگامی که یک الکترون به یک مولکول یا اتم خنثی افزوده میشود) از خود نشان میدهند. در یک دوره از چپ به راست، شعاع اتمی کاهش مییابد این پدیده، به این دلیل است که با افزایش عدد اتمی در یک دوره شمار لایههای الکترونی ثابت است اما شمار پروتونها افزایش مییابد برای همین الکترونها بیشتر به سوی هسته کشیده میشوند.[۱۷] کاهش شعاع اتمی باعث افزایش انرژی یونی شدن میشود (از چپ به راست). هرچه پیوندها در یک عنصر محکم تر باشد انرژی بیشتری هم برای جداسازی یک الکترون نیاز است. الکتروندوستی مانند انرژی یونی شدن رفتار میکند و از چپ به راست افزایش مییابد چون کشش هسته بر روی الکترونها افزایش مییابد.[۱۴] همچنین مقدار Electron affinity هم در طول یک دوره اندکی تغییر میکند. فلزها (عنصرهای سمت چپ دوره) معمولا نسبت به نافلزها (سمت راست دوره) Electron affinity پایین تری دارند. این قانون برای گازهای نجیب برقرار نیست.[۱۸]
بلوک
چون لایهٔ آخر الکترونی از اهمیت ویژهای برخوردار است، جدول تناوبی به بخشهایی وابسته به این لایههای الکترونی تقسیم شده است. به هر یک از این بخشها یک بلوک می گویند.[۱۹] بلوک اس دربردارندهٔ دو گروه نخست جدول (فلزهای قلیایی و قلیایی خاکی) و دو عنصر هیدروژن و هلیم است. بلوک پی دربردارندهٔ شش گروه آخر جدول، گروههای ۱۳ تا ۱۸ آیوپاک (۳A تا ۸A در نامگذاری آمریکایی) است. همهٔ شبهفلزات در این بلوک جای میگیرند. بلوک دی دربردارندهٔ گروههای ۳ تا ۱۲ آیوپاک (۳B تا ۸B در نامگذاری آمریکایی) و همهٔ فلزات واسطه است. بلوک اف که بیشتر در پایین بدنهٔ اصلی جدول جای میگیرد دربردارندهٔ لانتانیدها و اکتینیدها است.[۲۰]
دیگر قراردادها
در نمایش جدول تناوبی، لانتانیدها و اکتینیدها بیشتر به صورت دو ردیف اضافی در زیر بدنهٔ اصلی جدول گذاشته میشوند،[۲۱] همچنین در این نمایش دو تک خانه از بدنهٔ اصلی جدول به یکی از عنصرهای این دو مجموعه اختصاص داده میشود. برای نمونه یکی از عنصرهای لانتانیوم یا لوتتیم (برای لانتانیدها) و اکتینیم یا لارنسیم (برای اکتینیدها) را بر میگزینند و آنها را به ترتیب در یک تک خانه میان باریم و هافنیم، و رادیم و رادرفوردیم میگذارند. در دیگر جدولها دو مجموعهٔ لانتانیدها و اکتینیدها به صورت دو ردیف (دوره) در میانهٔ بدنهٔ اصلی جدول جای داده میشود.
|
جدول تناوبی با بلوک اف که به صورت جداگانه در پایین آمده (چپ)، بلوک اف در میانهٔ جدول (راست) |
|
در برخی جدولها یک خط جداکنندهٔ فلزها از نافلزها هم گنجانده میشود.[۲۲] همچنین ممکن است در یک جدول دستههای گوناگونی از عنصرها برجسته تر نمایان شوند، برای نمونه میتوان به فلزهای واسطه، Post-transition metal و شبهفلزها اشاره کرد.[۲۳] همچنین بسته به کاربرد جدول، ممکن است گروههای ویژهای از عنصرها مانند فلزهای مقاوم (در برابر گرما) و فلزهای کمیاب که خود زیرگروه فلزهای واسطهاند هم ممکن است گاهی پررنگ تر نمایش داده شوند.[۲۴][۲۵]
ویژگیهای تناوبی
آرایش الکترونی
نوشتار اصلی: آرایش الکترونی
روش پرکردن لایههای الکترونی رو به تراز انرژی بالاتر برپایهٔ اصل آفبا.
جدول تناوبی به همراه برخی ویژگیهای تناوبی در عنصرها.
آرایش الکترونی عنصرهای جدول، الگویی تکرار شونده دارند. الکترونها در هر عنصر، مجموعهای از لایههای الکترونی را پُر میکند. هر لایهٔ الکترونی از یک یا چند زیرلایه ساخته شده است که به آنها لایههای s و p و d و f و g گفته میشود. هر چه عدد اتمی افزایش یابد، لایهها و زیرلایههای الکترونی بیشتری پُر میشود. این لایهها بر پایهٔ اصل آفبا یا قانون تراز انرژی پر میشوند (همانند نموداری که کشیده شده است). برای نمونه آرایش الکترونی نئون با عدد اتمی ۱۰ عبارت است از: 1s2 2s2 2p6 که دو الکترون در لایهٔ نخست و هشت الکترون در لایهٔ دوم (دو تا در زیرلایهٔs و شش تا در زیرلایهٔp) جای میگیرد. برای نمونه فلزهای قلیایی و عنصر هیدروژن همگی تنها یک الکترون در لایهٔ اس دارند.[۲۶][۲۷]
ویژگیهای یک عنصر بیشتر به آرایش الکترونی اش وابسته است درنتیجه چون آرایش الکترونی عنصرها در جدول از نظم روشنی پیروی میکند، میتوان برخی رفتارهای فیزیکی و شیمیایی عنصرها در جدول را پیش بینی کرد. در جدول کناری به برخی از این رفتارها اشاره شده است. پیش از آنکه نیلز بور نظریه اش پیرامون آرایش الکترونی را مطرح کند، با توجه به این ویژگی پلهکانی عنصرها، جای عنصرها در جدول پیش بینی شده بود.[۲۶][۲۷]
شعاع اتمی
انرژی یونش
توضیح
از آنجائیکه الکترونهای خارجیترین لایه، خواص شیمیایی را تعیین مینمایند، این لایهها در میان گروهای یکسان مشابهاند. عناصر همجوار با یکدیگر در یک گروه، علیرغم اختلاف مهم در جرم، دارای خواص فیزیکی مشابه هستند. عناصر همجوار با یکدیگر در یک ردیف دارای جرمهای مشابه ولی خواص متفاوت هستند.
برای مثال، عناصر بسیار نزدیک به نیتروژن (N) در ردیف دوم کربن(C) و اکسیژن(O) هستند. علیرغم تشابه آنها در جرم (که بصورت ناچیزی در واحد جرم اتمی تفاوت دارند)، دارای خواص بینهایت متفاوتی هستند، همانطور که با بررسی فرمهای دیگر میتوان ملاحظه نمود: اکسیژن دو اتمی یک کاز است که سوختن را تشدید مینماید، نیتروژن دو اتمی یک گاز است که سوختن را تشدید نمیکند، و کربن یک جامد است که میتواند سوزانده شود (بله، میتوان الماس را سوزاند!).
در مقایسه، عناصر بسیار نزدیک به کلر (Cl) در گروه یکی مانده به آخر در جدول (هالوژنها) فلوئور(F) و برم(Br) هستند. علیرغم تفاوت فاحش جرم آنها در گروه، فرمهای دیگر آنها دارای خواص بسیار مشابه هستند: آنها بسیار خورنده (بدین معنی که تمایل خوبی برای ترکیب با فلزات، برای تشکیل نمکهالاید فلز)؛ کلر و فلوئور گاز هستند، درحالیکه برم یک مایع با تبخیر بسیار کم است؛ کلر و برم بسیار رنگی هستند.


 کانی
کانی  شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی
شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی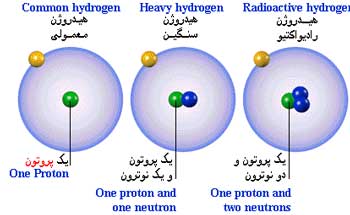 ایزوتوپ - سعید رفیع زاده
ایزوتوپ - سعید رفیع زاده