| عنوان | پاسخ | بازدید | توسط |
| |
1 | 130 | alireza663 |
| |
8 | 5007 | mina |
| |
0 | 2432 | alex |
| |
0 | 2808 | alex |
| |
0 | 1292 | hesam |
| |
0 | 1546 | hesam |
| |
0 | 1279 | hesam |
| |
0 | 2342 | hesam |
| |
0 | 1286 | hesam |
| |
0 | 1549 | hesam |
کاربرد
نیتروژن همچنین بهصورت ماده خنک کننده ، برای هم منجمد کردن غذا و هم حمل و نقل آن ، نگهداری اجساد و سلولهای تناسلی (اسپرم و تخم مرغ) و در بیولوژی برای نگهداری پایدار از نمونههای زیستی کاربرد دارد. نمک اسید نیتریک شامل ترکیبات مهمی مانند نیترات پتاسیم و سدیم و نیترات آمونیم میباشد که اولی ، برای تولید باروت و دومی برای تولید کودبکار میرود. ترکیبات نیترات شده مانند نیتروگلیسرین و ترینیترو تولوئن (TNT) معمولا منفجر شونده هستند.
اسید نیتریک بهعنوان ماده اکسید کننده در مایع سوخت راکتها استفاده میشود.هیدرازین و مشتقات آن نیز در سوختراکتها بکار میروند. نیتروژن ، اغلب درمبردها (Cryogenic) ، بهصورت مایع (معمولا(LN2استفاده میشود. نیتروژن مایع با عمل تقطیر هوا بدست میآید. در فشار جو ، نیتروژن در دمای 195.8- درجه سانتیگراد (320.4- درجه فارنهایت) مایع میشود.
زيرزمينی يونهايي مانند Ca2+، Mg2+ و Fe2+ را درخود حل میکند که باعث آلوده شدن طبيعی آب ميشود. وجود املاح گفته شده در آب باعث ميشود صابون معمولي در آن کف نکند ، از اينرو اينآب ها را آب سخت نامگذاری کردند.

واکنش فوق از جمله واکنش هایی است که منجر به تولید کف می شود . این واکنش بین جوش شیرین ( سدیم بی کربنات یا سدیم هیدروژن کربنات ) با آلومینیوم سولفات انجام می شود که به مقدار زیاد گاز کربن دی اکسید تولید می کند از این واکنش برای خاموش کردن آتش استفاده می شود.
اطلاعاتی خواندنی در مورد جدول تناوبی
مندلیف و لوتار میردر موردخواص عنصرهاو ارتباط انها بررسی های دقیق تری انجام دادند ودر سال 1869 به این نتیجه رسیدند که خواص عنصرها تابعی تناوبی از جرم انهاست. به این معنا که اگر عنصرها را به ترتیب افزایش جرم اتمی مرتب شوند نوعی تناوب در انها اشکار میگرددوپس ازتعداد معینی از عنصرها عنصرهایی با خواص مشابه خواص پیشین تکرار می شوند .
مندلیف در سال 1869 بر پایه ی قانون تناوب جدولی از 63 عنصر شناخته شده ی زمان خود منتشر کرد.
در فاصله ی بین سالهای 1869 تا 1871م مندلیف هم مانند لوتار میر با بررسی خواص عنصرها و ترکیب های انها متوجه شد که تغییرهای خواص شیمیا یی عنصرها مانند خواص فیزیکی انها نسبت به جرم اتمی روند تناوبی دارد.از این رو جدول جدیدی در 8 ستون و12سطر تنظیم کرد.او با توجه به نارسایی های جدول نیو لندز ولوتار میر و حتی جدول قبلی خود جدولی تقریبابدون نقص ارایه دادکه فراگیر وماندنی شد.
شاهکارهای مندلیف در ساخت شهرک عناصر:
روابط همسایگی:دانشمندان پیش از مندلیف در طبقه بندی عناصر هر یک را جداگانه و بدون
وابستگی به سایر عناصر در نظر می گرفتند.اما مندلیف خاصیتی را کشف کرد که روابط بین عنصرها را به درستی نشان میدادو ان را پایه تنظیم عناصر قرار داد.
وسواس وی:او برخی از عناصر را دوباره بررسی کرد تا هر نوع ایرادی را که به نادرست بودن جرم اتمی از بین ببرد.در برخی موارد به حکم ضرورت اصل تشابه خواص در گروهها را بر قاعده افزایش جرم اتمی مقدم شمرد.
واحدهای خالی:در برخی موارد در جدول جای خالی منظور کردیعنی هر جا که بر حسب افزایش جرم اتمی عناصر باید در زیر عنصر دیگری جای می گرفت که در خواص به ان شباهتی نداشت ان مکان را خالی می گذاشتو ان عنصر را در جایی که تشابه خواص رعایت میشد جای داد.این خود به پیش بینی تعدادی ا زعنصرهای ناشناخته منتهی شد.
استقبال از ساکنان بعدی:مندلیف با توجه به موقعیت عنصرهای کشف نشده و با بهره گیری از طبقه بندی دوبرایزتوانستخواص انها را پیش بینی کند.برای نمونه مندلیف در جدولی که در سال 1869 تنظیم کرده بودمس و نقره وطلا را مانند فلزی قلیایی در ستون نخست جا داده بود اما کمی بعد عناصر این ستون را به دو گروه اصلی و فرعی تقسیم کرد.سپس دوره های نخست و دوم و سوم هر یک شامل یک سطر و هر یک از دوره های چهارم به بعد شامل دو سطر شده وبه ترتیب از دوره های چهارم به بعد دو خانه اول وشش خانه اخر از سطر دوم مربوط به عناصر اصلی ان دوره و هشت خانه باقی مانده ی سطر اول و دو خانه اول سطر دوم مربوط به عناصر فرعی بود
ساخت واحد مسکونی هشتم:مندلیف با توجه به این که عناصراهن وکبالت ونیکل وروتینیم ورودیم وپالادیم واسمیم وایریدیم وپلاتینخواص نسبتا با یکدیگر دارند این عناصر را در سه ردیف سه تایی و در ستون جداگانه ای جای دادو به جدول پیشین خود گروه هشتم ا هم افزود
در ان زمان گازهای نجیب شناخته نشده بوداز این رودر متن جدول اصلی مندلیف جایی برای این عناصر پیش بینی نشد. پس از ان رامسی و رایله در سال 1894 گاز ارگون را کشف کردند و تا سا ل 1908 م گازهای نجیب دیگرکشف شد و ظرفیت شیمیایی انها 0 در نظر گرفته شدو به گازهای بی اثر شهرت یافتند
اسانسور مندلیفبه سوی اسمان شیمی :جدول مندلیف در تنظیم و پایدار کردن جرم اتمی بسیاری از موارد مندلیفنادرست بودن جرم اتمی برخی از عناصر را ثابت و برخی دیگر را درست کرد .جدول تناوبی نه تنها به کشف عنصرهای ناشناخته کمک کرد بلکه در گسترش و کامل کردن نظریه ی اتمی نقش بزرگی بر عهده داشت و سبب اسان شدن بررسی عناصر و ترکیب های انها شد.
مجتمع نیمه تمام:جدول تناوبی با نارسایی هایی همراه بود که عبارتند از :
1-جای هیدروژن در جدول بطور دقیق مشخص نبود .گاهی ان را بالا ی گروه فلزهای قلیایی و گاهی بالای گروه های گروه هالوژن ها جا میداد.
2-در نیکل و کبالت که جرم اتمی نزدیک به هم دارند خواص شیمیایی متفاوت است و با پایه قانون تناوبی ناسازگاری دارد.
3-کبالت را پیش از نیکل و همچنین تلور را پیش از ید جای داد که با ترتیب صعودی جرم اتمی هم خوانی نداشت .با پیش رفت پژوهش ها و با کشف پرتوایکس و عنصرهاو بررسی دقیق طیف انها عدد اتمی کشف و اشکار شد و عناصر بر حسب افزایش عدد اتمی مرتب و
نار سایی های جزیی موجود در جدول مندلیف از بین رفت .زیرا تغییرات خواص عناصر نسبت به عدد اتمی از نظم بیشتری برخوردارست تا جرم اتمی انها .
4سال پس از نشر جدول مندلیف بوابو در ات به روش طیف نگاری اکا الومینیوم را کشف کرد و گالیم نامید و 4 سال بعد نیلسون اکا بور را کشف کرد و اسکاندیم نامید و هفت سال بعد ونیکلر هم اکا سیلسیم را از راه تجربه طیفی کشف کرد و ان را ژرمانیم نامید.
تغییرات خواص عناصر در دوره ها و گروههای جدول:
1-تغییرات شعاع اتمی :در هر گروه با افزایش عدد اتمی شعاع اتمی افزایش می یابد ودر هر دوره با افزایش عدد اتمی شعاع اتمی به تدریج کوچکتر می گردد.
2-تغییرات شعاع یونی :شعاع یون کاتیون هر فلز از شعاع اتمی ان کوچکتر و شعاع هر نا فلز از شعاع اتمی ان بزرگتر است.به طور کلی تغییرهای شعاع یونی همان روند تغییرات شعاع اتمی است.
3-تغییرات انرژی یونش: در هر دوره با افزایش عدد اتمی انرژی یونش افزایش
می یابد و در هر گروه با افزایش لایه های الکترونی انرژی یونش کاهش می یابد.
4-تغییرات الکترون خواهی :در هر دوره با افزایش عدد اتمی انرژی الکترونخواهی افزایش می یابدودر هر گروه با افزایش عدد اتمی اصولا انرژی الکترون خواهی از بالا به پایین کم می شود .
5-تغییرات الکترونگاتیوی:در هر دوره به علت افزایش نسبتا زیا د شعاع اتمی الکترونگاتیوی عناصر کم میشود و در هر دوره به علت کاهش شعاع اتمی الکترونگاتیوی عناصر افزایش می یابد .
6-تغییرتعدادالکترونهای لایه ظرفیتوعدد اکسایش:در هر دوره از عنصری به عنصر دیگریک واحد به تعداد الکترون ها ی ظرفیت افزوده میشود و تعداد این الکترونها و عدد اکسایش در عنصرهای هر گروه با هم برابرند.
7-تغییرات پتانسیل الکترودی :در ازای هردوره با افزایش عدد اتمی توانایی کاهندگی عنصرها کاهش می یابد و توانایی اکسیدکنندگی انها افزایش می یابد .از این روفلزهایی که در سمت چپ دوره ها جای دارندخاصیت کاهندگی ونا فلزهایی که در سمت راست دوره ها جای دارندتوانایی اکسید کنندگی دارند.در موردعناصر یک گروه توانایی اکسید –کنندگی با افزایش عدد اتمی وپتانسیل کاهش می یابد.
8-تغییرات توانایی بازی هیدروکسید:توانایی بازی هیدروکسیدعناصر در گروهها ازبالا به پایین افزایش می یابد اما در دوره از سمت چپ به راست رو به کاهش است.
9-تغییرات دما وذوب یا جو ش:در هر دوره دمای ذوب و جوش تا اندازه ای به طورتناوبی تغییر می کند ولی این روندمنظم نیست و در موردعناصرگروهها نیز روندواحدی وجود ندارد
چگالی و غلظت
چگالی
در علوم پایه چگالی را مقدار جرم موجود در واحد حجم ماده میدانند. و آن را با علامت اختصاری ρ نشان میدهند که از رابطه ρ=m/V به دست میآید. در صورتی که در علوم پیشرفته، این تعریف از چگالی صحیح نیست و دقیقا تعریف جرم واحد حجم یا جرم مخصوص یا همان دانسیته میباشد. در علم کل، وزن مخصوص یک ماده به وزن آب همحجم آن را در شرایط استاندارد، چگالی میگویند و ان را با S نشان میدهند.
در رابطهٔ ذکر شده، ρ چگالی ماده، m جرم جسم و V حجم اشغال شده توسط آن مادهاست. همچنین، بین چگالی و وزن مخصوص باید تفاوت قائل شد. چگالی مقدار جرم موجود در واحد حجم است، ولی وزن مخصوص به معنی وزن واحد حجم مادهاست.
جرم مخصوص یا دانسیته جرم واحد حجم است. جرم مخصوص را با ρ نشان میدهند.
برای تعریف جرم مخصوص در یک نقطه، حجم کوچکی در اطراف نقطه در نظر گرفته و جرم سیال را داخل آن حجم تقسیم نموده و حد این نسبت را وقتی تغییرات حجم به اپسیلون میل میکند میگیریم. درخور ذکر است که اپسیلون در اینجا درست است که واحد بسیار کوچکی است، اما از فاصلهٓ متوسط مولکولهای جسم، بزرگتر است.
غلظت
غلظت یک محلول شیمیایی به مقدار مادهی حل شدهای که در مادهی حل شونده، حل شده است، ربط دارد. تصور ما بر این است که جامدی به یک حل کننده اضافه میشود (مثلاً نمک به آب) اما مادهی حلشده در فاز دیگری است. برای مثال، اگر مقدار کمی اتانول به آب اضافه کنیم، اتانول، مادهی حلشده است و آب حلال. اگر مقدار کمتری آب به مقدار بیشتری اتانول اضافه کنیم، آب نقش مادهی حلشده را خواهد داشت.
غلظت مولی
بيشتر واکنشهاي شيميايي در محلولها و بخصوص محلولهاي آبي صورت مي گيرند. استوکيومتري واکنشها بر حسب مول تفسير مي شود. بنابر اين در محاسبه هاي استوکيومتري محلولها از «غلظت مولي» استفاده مي کنيم. غلظت مولي يا مولاريته عبارت است از تعداد مولهاي حل شده از يک ماده در ليتر محلول.
رابطه ی غلظت مولی یک ماده خالص با چگالی و جرم مولی آن
از تقسیم کردن چگالی یک ماده خالص ( با یکای گرم بر لیتر ) بر جرم مولی آن ، غلظت مولی آن به دست می آید.
اگر یک ماده خالص حالت جامد یا مایع داشته باشد چگالی و جرم مولی آن مقداری معین وثابت است ( در دمای معین ). به همین دلیل است که غلظت یک ماده خالص دارای حالت مایع یا جامد ، مقداری ثابت و معین است.
تاریخچه
اولین گزارش های سنگ ادراری شاید مربوط به سنگ هایی باشد که بین اسکلت یک مصری که در 4800 سال قبل از میلاد مسیح می زیسته باشد. همین طور جراحی هایی که برای سنگ ادراری انجام شده اند نیز جزو اولین اعمال جراحی محسوب می شوند.
علایم سنگ کلیه
درد حاد اغلب ناشی از گیرکردن سنگ در مجاری ادراری است وگرنه خود سنگ اغلب علامتی ندارد. انسداد، عفونت، خیز درد شدید در منطقه دندهای مهرهای، تهوع، استفراغ و اسهال است. درد بسیار شدید و شبیه به درد زایمان است، هماچوری یا خون ادراری در این افراد دیده میشود.
هدف فوری درمان درد و هدف طولانی جلوگیری از تخریب نفرون است. نفرون نام واحدهای ساختاری کلیه است که لوله پیچیدهای متشکل از یک لایه بافت پوششی است و در یک انتها بسته و در انتهای دیگر به درون لگنچه باز میشود. سنگ کلیه میتواند کشنده باشد.
درمان
حمام یا بخار آب گرم و مصرف مایعات در صورت عدم منع مفید است. بیماران باید رژیم غذایی را رعایت کنند و در طول روز هر یک الی دو لیتر آب بنوشند، از فعالیت زیاد بپرهیزند، با مشاهده اولین عفونت ادراری به پزشک مراجعه کنند، هر چند وقت یک بار آزمایش ادرار انجام دهندو مراقب افزایش میزان اوره و کراتیین و نیتروژن اوره خون خود باشند.
در صورتی که سنگ بزرگتر از یک سانتیمتر باشد از عمل جراحی استفاده میکنند. برای درمان از لیزر،ESWL، TUL ، سیستوسکوپی، نفرولیتوتومی و کمولیز استفاده میکنند.
هنگام ایجاد درد حاد (اغلب ناشی از گیرکردن سنگ در مجاری) مسکنهای مخدر و غیراستروئیدی مفید هستند. معمولاً در چنین مواقعی اساس درمان انتظار برای دفع سنگ از طریق جریان ادرار است.
در صفحه 33: داده های جدول در دمای نزدیك به دمای اتاق است.
در صفحه 38 :لانتانیدها خانه های 57 - 70 و آكتنیدها خانه های 89-102 جدول را دربر می گیرند.
باید توجه داشته باشید كه علت قرار گرفتن لانتانیم در دسته ی d یا f جزو اهداف آموزشی كتاب درسی نیست .
همچنین تمامی رفتار عنصرهای ردیف ششم و هفتم شناخته نشده است و تحقیقات علمی گسترده ایی در حال انجام است.
منبع: وبسایت دفتر برنامه ریزی و تالیف کتب درسی
موجودات آبزی
زندگي در كره ما در اقيانوس بوجود آمده و سپس به خشكي انتقال يافته است. آب بعنوان محيط زندگي موجودات آبزي بهترين مايعي است كه ميتوان تصور كرد. از خواص بسيار مساعد آب براي آبزيان خواص زير، شايان توجه مي باشند:
1 ـ حرارت مخصوص آب زياد است، بنابراين گرم وسرد شدن بتدريج انجام مي گيرد و اين، عامل مثبتي براي موجودات زنده مي باشد.
2 ـ بر خلاف ساير اجسام ( به استثناء چدن و بعضي ديگر ) آب در صورت انجماد بجاي انقباض، بميزان 9 درصد انبساط حاصل مي كند. اگر آب هنگام انجماد منبسط نمي شد و به سطح نمي آمد بلكه ته نشست ميشد، بسياري از درياها، درياچه ها، رودخانه ها و غيره بويژه در مناطق سرد تا ته منجمد ميشدند.
3 ـ آب حلالي بهتر از هر مايع ديگر ميباشد. در آب دريا و آب شيرين مقداري املاح حل شده اند كه بدون آنها زندگي جانوران و گياهان آبزي مقدور نميشد. خواص الكتروليتي آب نيز مهم است. يونهاي املاح كه بحالت محلول در آب يافت ميگردند در فعل و انفعالات شيميايي اعم از داخل بدن موجودات جانوري و يا در خارج آنها ( در محيط آب) شركت مي نمايند.
4 ـ آب قسمت مهمي از تركيبات شيميايي را كه در بافت زنده يافت ميگردد، تشكيل مي دهند. مثلا دو سوم وزن بدن انسان آب است. مانند خشكي ( زمين )، در دريا نيز پايه زنجير غذايي موجودات زنده را گياهان كلروفيلدار تشكيل مي دهند ، زيرا آنها هستند كه از مواد معدني غذاي آلي ميسازند و بقيه موجودات از غذاي آماده تغذيه مي نمايند. ميتوان يك زنجير غذايي ساده را در دريا بدين قرار آورد: پلانكتن گياهي ( فيتوپلانكتن ) ـ پلانكتن جانوري ( زوئو پلانكتن) ـ ماهي ـ انسان.
RE: موجودات آبزی
گياهان دريايي به دو قسمت تقسيم مي گردند : فيتوپلانكتنها كه جلبكهاي تك ياخته اي ميكروسكوپي هستند و گياهان پر ياخته ( ماكروفيت Macrophytes ). فيتو پلانكتن اهميت اساسي دارد و شامل بيش از 99 در صد تمام زندگي گياهان مي باشد. قسمت عمده ماكروفيت ها جلبك هاي پر ياخته اند اينها نيز به استثناء برخي ، مانند فيتوپلانكتن ، فتوسنتز انجام مي دهند، علاوه بر اينها ؛ در سواحل اقيانوسها در مناطق معتدله گياهان گلدار نيز يافت مي گردند كه بطور ثانوي دريا را محل سكونت خود قرار داده اند و گاهي چمن هاي زير آبي تشكيل ميدهند( بويژه Zostera ). موجودات جانوري در تمام ضخامت ( ارتفاع) اقيانوس اعم از طبقات مختلف آب و ته اقيانوس وجود دارند ولي انتشار گياهان از سطح تقريبا تا عمق 200 متر است كه حد جذب حداقل مقدار نور خورشيد جهت رشد فيتوپلانكتون مي باشد. در آبهاي ساحلي كه داراي مواد معلق بمقدار قابل توجه و برنگ تيره هستند نور خورشيد جهت رشد سريعا جذب مي شود و حداقل مقدار نور مورد نياز براي رشد فيتوپلانكتن ممكن است در عمق 5 يا 10 متر باشد ولي در آبهاي اقيانوسي كه شفافند مي تواند تا 200 متر نفوذ كند، منطقه ايكه نور كافي براي رشد گياه دارد منطقه روشنايي (Photic zone) ناميده ميشود. در داخل اين منطقه فيتوپلانكتن بكمك ذرات سنتز كننده خود انيدريدكربنيك را در آب به ماده گياهي تبديل ميكند ( فتوسنتز ). انيدريد كربنيك هميشه بحد وفور موجود است. گياه در حال رشد مواد لازم را نيز از آب مي گيرد فقط بعضي از مواد خيلي لازم مانند فسفات ها و نيترات ها كه املاح غذايي اقيانوس ناميده مي شوند اغلب اوقات كم بوده و ممكن است عامل محدود كننده باشند.
RE: موجودات آبزی
پلانكتونها
موجودات اكثرا بسيار كوچك مي باشند، توده آب را مسكون مي سازند و توسط جريانات آب و امواج غير فعالانه تغيير مكان مي دهند . اين موجودات يا استعداد حركت مستقل ندارند يا خيلي كم دارند و نمي توانند مانع از برده شدن توسط جريان ها و امواج آب شوند. در تركيب پلانكتن ، گياهان و جانورن واردند . پلانكتن گياهي (Phytoplankton) كه احتياج به نور خورشيد دارد. ، در طبقه بالا متمركز ميشود ولي پلانكتن جانوري (Zooplankton) در تمام طبقات آب آبگير توزيع يافته است. تنوع پلانكتن در دريا به مراتب غني تر از آبهاي شيرين است. اندازه موجودات پلانكتني بسيار مختلف مي باشد: از چند ميكرون ( باكتريها)تا 2 متر (مدوزCyanea ) . فرمولهاي گياهي پلانكتن تقريبا همگي تك ياختگان گياهي ميكروسكوپي هستند. بيش از همه دياتومه ها (Diatomea) مي باشند . دياتومه ها جلبكهايي هستند كه در صدف ويژه سيليسي شبيه به جعبه سر-پوشدار جاي گرفته اند.
RE: موجودات آبزی
زئوپلانكتن:
گلوبيژرين (Globigerina) از فورامينيفرها شعاعيان( (vhnd,gvih، بعضي مژه دارن ، ازتاژكد اران (Noctiuca) كيسه تنان ، لاروهاي كرمها و بعضي فرمهاي ديگر بويژه خرچنگيان (Crustacea) بسيار مهمند مانند خرچنگيان پست كوپه پدا وكلاد وسراويالارو خرچنگها (ميگووكراب) . كوپه پدها قسمت عمده زوئوپلانكتن دريا را تشكيل ميدهند. تخمها و لاروهاي بسياري از ماهيها و لاروهاي عده اي از سايرجانوران و بعضي بالغ نيز جزو زوئوپلانكتن مي باشند. موجودات زوئوپلانكتني روزانه مهاجرت هاي عمودي انجام مي دهند: در شب بسطح آب ميآيند ولي روزها به چند صد متري پائين مي روند. گذشته از اينها طبقات آب دريا از تعداد بيشماري باكتريها مسكون گشته اند.پ
MTBE (متيل ترسيو – بوتيل اتر) يك ماده آلي اكسيژن دار است كه امروزه در ايران و برخي كشورهاي جهان به صورت گسترده در بنزين بدون سرب استفاده مي شود در ابتداي انتخاب و استفاد ه از اين ماده در سوخت مزاياي زيست محيطي آن مورد توجه بود ولي اكنون پس از گذشت چند سال از مصرف آن در دنيا مشخص شده است كه تاثيرات سوء روي انسان بوده و داراي پتانسيل آلودگي محيط زيست است. ورود MTBE به منابع آب و خاك به روشهاي مختلف انجام مي گيرد .MTBE در خاك بسيار متحرك است و حركت آن در آب تابع قوانين حركت آب در خاك است. MTBE مقاومت زيادي به تخريب زيستي دارد و نيمه عمر آن در آب بالاست ، جذب آنها توسط ذرات خاك ضعيف است ،حلاليت بالايي در آب دارد و بسيار متحرك است . اين عوامل باعث حركت MTBE به سمت آبهاي زير زميني و جمع اين ماده در اين آبها مي گردد و از آنجا كه آبهاي زيرزميني در شرب و كشاورزي استفاده دارند با تهديد سلامتي انسان و طبيعت باعث معضلات زيست محيطي مي گردد درحال حاضر USEPA حد مجاز اين ماده در آبهاي آشاميدني راpb 40-20 تعيين كرده است. با توجه به مصرف گسترده MTBE در ايران قبل از آنكه اين ماده به معضل زيست محيطي در كشور تبديل گردد بايد راهكارهي مناسب ادامه و عدم مصرف آن مشخص شود. متيل ترسيو يک ماده آلی مصنوعی اکسيژن دار است که پس از اثبات جنبه های سوء بهداشتی و زيست محيطی سرب بعنوان جايگزين آن معرفی و امروزه در ايران و برخی از کشورای جهان بصورت گسترده در بنزينهای بدون سرب استفاده می شود.توجه به اين ماده در دهه ۷۰ ميلادی آغاز و مصرف آن در دهه ۸۰ و ۹۰ ميلادی در جهان افزايش يافت. در ابتدای انتخاب و استفاده از اين ماده در سوخت مزايای زيست محيطی آن مورد توجه بود که مهمترين آنها افزايش عدد اکتان بنزين٫ کاهش نشر گازهای آلاينده منتشر از اگزوز خودرو مانند منواکسيد کربن و ازن ٫ حذف سرب از بنزين به همراه تاثير بهبود نسبی کيفيت هوا ٫توليد آسان و سهولت اختلاط با بنزين می باشد ولی اکنون پس از گذشت چند سال از مصرف آن در دنيا مشخص شده است که MTBE دارای امکان تاثيرات سوء روی بدن انسان و مضرات زيست محيطی بودند و آلودگی آبها زير زمينی از مهمترين جنبه های زيست محيطی آن می باشد . در آمريکا از سال ۱۹۹۷ تا ۲۰۰۱ ميلادی دو سيستم تامين کننده نياز آب شرب شهری بخاطر آلودگی MTBE برای اين منظور غير قابل استفاده شدند.در سانتامونيکای آمريکا حداقل ۵۰ درصد از کل آب شهری که از منابع زيرزمينی تامين می شدبرای شرب غير قابل استفاده گرديد بطوريکه ۵/۳ ميليون دلار برای جايگزينو تامين آب شرب منطقه هزينه شد. وجود MTBE در کاليفرنيا در نمونه های شهری عموما با مقادير کمتر از ۲mg/l گزارش شده است. در شرايط خاص در جاهايی که قايقهای موتوری استفاده می شد غلظت اين ماده در آن آبها به۱۲ppm هم می رسد. در تحقيقی که در سال۱۹۹۶ توسط USGS در ۱۶ شهر آمريکا انجام شد ٫ مقدار MTBE موجود در آبهای سطحی بين µg/L 100-2/0 گزارش شد که غلظتهای بيشتر بين ماه های اکتبر تا مارس واقع شده است.(۳).در آمريکا به خاطر تاثيرات اين ماده در انسان و محيط زيست به ويژه آلودگی منابع آب اعتراضات فراوانی نسبت به ادامه مصرف آن وجود دارد ودر بعضی مناطق استفاده از MTBEممنوع شده است در اين مقاله برسی توانايی MTBEدر آلودگی منابع آب سه محور اصلی مورد توجه است تاثيرات MTBE روی سلامتی انسان چگونگی ورود MTBE به منابع آب وسرنوشت MTBE در منابع آب .متيل ترسيو بوتيلاتر يک ترکيب آلی با فرمول شيميايی C5H12O می باشد در دما وفشار استاندارد مايعی بی بيرنگ ٫ قابل اشتعال و قابل احتراق است . جرم مولکولی آن ۱۵/۸۸ بوده و دارای نقطه ذوب ۹-ـ درجه سانتی گراد ونقطه جوش ۶/۵۳ - ۲/۵۵ درجه سانتی گراد می باشد . چگالی اين ماده ۷۴۴/۰ ۷۵۸/۰ گزارش شده است . انحلال پذيری MTBE در آب بسيار بالاست 540mg/L گرارش شده است.انسان از سه طريق خوردن يا آشاميدن ، اشتنشاق وتماس پوستي مي تواند در معرض MTBE قرار گيرد و سلامتي او تهديد گردد كه از اين بين بلع مهمترين راه ورود اين ماده به بدن انسان است و عمدتاً از طريق آشاميدن آب آلوده انجام مي شود، ضمن آنكه استحمام با آب گرم آلوده نيز فراريت آن را افزايش داده و باعث استنشاق اين ماده مي گردد . تاثيرات اين ماده روي بدن به دو قسمت سرطانيو غير سرطاني تقسيم مي شود . به دليل زمان نسبتاً كوتاه از آغاز مصرف گسترده اين ماده تحقيقات ومطالعات كافي براي برسي تاثيرات سرطان زائي در انسان انجام نشده است ولي اين موضوع هنگاميكه حيوانات آزمايشگاهي به صور مختلف در معرض مقادير بالاي MTBE قرار گرفتند اثبات گرديد. در يك آزمايش در آثر بلعيدن MTBE در موشهاي صحرايي ماده به مقدار mg 1000 به ازاء هر كيلوگرم وزن بدن در روز طي يك دوره 104 روزهاين موشها به سرطان خون مبتلا شدند وهمين تيمار در موشهاي صحرايي نر در دوره فوق باعث بروز تومورهاي بيضوي در آنها گرديد. طي تحقيقاتي در يك دوره18 ماهه ، استنشاق اين ماده توسط موشهاي صحرايي نر وماده صورت گرفت و خاصيت سرطان زايي MTBE در اين حيوانات آزمايشگاهي مشاهده گرديد . بر همين اساس USEPA اين ماده را در گروه داراي امكانم سرطان زائي قرار داده است . در مورد تا ثيرات غير سرطاني MTBE، از مهمترين وشايعترين عوارض تنفس آندر انسان سردرد ،سرگيجه،تهوع،آلرژي و مشكلات تنفسي مي باشد در آزمايشي روي موش صحرايي با بلعيدن mg 70 به ازاء هر كيلوگرم وزن بدن در روز تاثيري مشاهده نشد واز mg 100 به ازاء هر كيلوگرم وزن بدن در روزعوارض آن مشاهده گرديد(2). براي ارزيابي صحيح از سميت اين ماده بر روي آنسان نياز به مطالعات وتحقيقات بيشتري مي باشد . ضمن آنكه در مواردي مانند تاثير روي ژنتيك ،توليد مثلو رشد اطلاعات بسيار محدود است .
امروزه پیشرفت تکنولوژی و دستیابی انسان به روشهای نوین برای استفاده از منابع طبیعی دستاوردهایی را به همراه دارد که علاوه بر تاثیرات فراوان در زندگی بشر، تاثیراتی منفی را نیز برای طبیعت به ارمغان میآورد.
به تازگی انسان متمدن به این تفکر رسیده است که شاید بتوان با استفاده از تکنولوژی مدرن و پیشرفته به کمک منابع طبیعی و محیطزیست شتابد که ازجمله آنها میتوان به فناوری نانو و کاربرد آن در حفظ محیطزیست اشاره کرد.
تاثیرات مستقیم و غیرمستقیم فناوری نانو بر محیطزیست، از جنبههای مختلف قابل بررسی است. در حال حاضر، میتوان موارد متعددی از کاربرد مواد نانو ساختاری در حفظ محیطزیست، از قبیل نانوفیلترها (برای تصفیه پسابهای صنعتی)، نانوپودرها (برای تصفیه گازهای آلاینده خروجی از خودروها و واحدهای صنعتی) و نانوتیوبها (برای ذخیرهسازی سوخت کاملا تمیز هیدروژن) را برشمرد، اما دورنمای استفاده از این فناوری نوین بسیار گستردهتر از این گونه کاربردهای جزئی و مقطعی است. برخی از مهمترین کاربردهای علمی شناخته شده فناوری نانو در زمینه محیطزیست نانوحسگرها، نانوفیلترها و کاتالیزورهای زیستمحیطی هستند که به ترتیب به آنها اشاره میشود:
● نانوحسگرها
نانوحسگر وسیلهای است بسیار ریز که قادر به شناسایی و ارائه پاسخ به محرکهای فیزیکی در مقیاس یک نانومتر است. نانوحسگرها کاربردهای متعددی در علوم مختلف ازجمله محیط زیست یافتهاند که در ادامه به چند مورد اشاره خواهد شد.
● آلودگی هوا
یکی از نیازهای مهم و اساسی در ارتباط با کنترل آلودگی محیطزیست، پایش مستمر آلودگی هواست. با استفاده از نانوحسگرها پیشرفت موثری در زمینه کنترل آلودگی هوإ؛ ّّ= صورت گرفت. با اختراع اولین نمونههای غبار هوشمند، تولید این گونه حسگرها به مرحله کاربرد علمی نزدیک شد. هدف اصلی از ساخت غبارهای هوشمند، تولید مجموعهای از حسگرهای پیشرفته به صورت نانو رایانههای بسیار سبک است. این نانوحسگرها به راحتی ساعتها در هوا معلق باقی میمانند. این ذرات بسیار ریز از سیلیکون ساخته میشوند و میتوانند از طریق بیسیم موجود در خود، اطلاعات جمعآوری شده را به یک پایگاه مرکزی ارسال کنند. سرعت انتقال اطلاعات در نمونههای اولیه حدود یک کیلوبایت در ثانیه است.
● نشت گازهای مهلک
نشت گازهای مهلک یکی از خطرات روزمره زندگی صنعتی است. متاسفانه هشداردهندههای موجود در صنعت اغلب بسیار دیر موفق به شناسایی این گونه گازهای نشتی میشوند. این نوع حسگرها از نانوتیوبهای تک لایه به ضخامت حدود یک نانومتر ساخته شدهاند و میتوانند مولکولهای گازهای سمی را جذب کنند. آنها همچنین قادر به شناسایی تعداد معدودی از مولکولهای گازهای مهلک در محیط هستند. محققان مدعیاند که این حسگرها برای شناسایی به هنگام گازهای بیوشیمیایی جنگی، آلایندههای هوا و حتی مولکولهای آلی موجود در فضا کاربرد خواهند داشت.
● نانوفیلترها
یکی دیگر از کاربردهای مهم فناوری نانو در محیط زیست، استفاده از نانوفیلترها در تصفیه آب و پساب است. غشای مورد استفاده در فرایند نانوفیلتراسیون معمولا مولکولهای بزرگ را دفع میکند و در مقایسه با روشهای دیگر قادرند با صرف انرژی کمتر آب چاهها یا آبهای سطحی را نیز به خوبی تصفیه کنند. این فرایند قادر است انواع باکتریها، ویروسها، آفتکشها، آلایندههایی با منشا آلی و املاح کلسیم و منیزیم را از آب جدا کند. نظر به این که در فرایند نانوفیلتراسیون از هیچ ماده شیمیایی برای سختیگیری آب استفاده نمیشود، بنابراین اثرات منفی زیستمحیطی آن به مراتب کمتر از روشهای شیمیایی معمول است.
علاوه بر این، ذرات نانوساختار انعطافپذیری زیادی در تصفیه آلایندهها دارند. به عنوان مثال از ذرات نانوساختار برای تصفیه فوری خاک، رسوبات، ضایعات جامد، تصفیه آب و پسماندهای مایع استفاده میشود. تحقیقات نشان میدهد که ذرات دوفلزی نانوساختار مانند آهن - پالادیم، آهن - نقره و روی - پالادیم کاربردهای زیادی در تصفیه و پالایش آلودهکنندههای محیط زیست، مانند آفتکشهای کلرینه با منشا آلی و حلالهای آلی هالوژنه یافتهاند.
تجربه نشان داده است که استفاده از ذرات نانوساختار دو فلزی موجب میشود تا کلیه هیدروکربنهای حاوی ترکیبات کلردار که بسیار سمیاند به هیدروکربنهای بیخطر برای محیط زیست تبدیل شوند.
به علاوه، شواهد بسیار مبین این واقعیت است که ذرات نانوساختار با پایه آهنی، قادر به تجزیه آلودگیهای بسیار پایدار همچون ترکیبات پرکلراتها، نیتراتها، فلزات سنگین (نیکل و جیوه) و مواد رادیواکتیو مانند دی اکسید اورانیوم هستند.
علاوه بر این میتوان از نانوساختارها برای رنگزدایی از آب آشامیدنی استفاده کرد. رنگ موجود در آب آشامیدنی نه تنها به خاطر ظاهر آن باید از آب زدوده شود، بلکه چون این رنگها میتوانند منشا تولیدتری هالومتان نیز باشند، بسیار خطرناک محسوب میشوند. این ماده هنگام ترکیب با کلر موجب تشکیل کلروفرم و دیگر ترکیبات هالوژنه مضر و سرطانزا میشوند. رنگ موجود در آب طبیعی معمولا ناشی از وجود اسیدهای معدنی است. اسیدهای مذکور از تجزیه مواد آلی موجود در آب حاصل میشوند. اغلب روشهای متداول برای تصفیه آب قادر به جداسازی مواد فوق نیستند، لیکن با استفاده از غشاهای نانو میتوان تا ۹۹ درصد این گونه مواد را به سهولت از آب جدا کرد. همچنین تحقیقات نشان میدهد استفاده از فناوری نانو در تصفیه آب میتواند هزینههای تصفیه را تا حدود زیادی کاهش دهد.
● نانوپلیمرهای متخلخل
هنگامی که آلایندههای آلی آب گریز از طریق آب وارد خاک میشوند، به راحتی توسط ذرات جامد غیرمحلول در آب جذب و از آب جدا میشوند. پدیده جذب و دفع این گونه آلایندهها از آب به خاک و از خاک به هوا بسیار پیچیده است و به عوامل متعددی از قبیل حلالیت در آب، آب موجود در شبکه خاک و رقابت اجزای مختلف خاک برای جذب این ذرات بستگی دارد. هنگامی که بیش از یک مولکول آب گریز در محیط وجود داشته باشد، مولکولهای آلاینده به جسمی متصل میشوند که از لحاظ شیمیایی بیشترین شباهت را به آنها داشته باشد. به همین دلیل نانوپلیمرهای متخلخل که شباهت زیادی به مولکولهای مواد آلاینده دارند، مناسبترین وسیله برای جداسازی این نوع آلایندههای آلی از آب و خاک به شمار میروند. به طور کلی کاربردهای زیستمحیطی این نانوساختارها عبارتند از:
۱ - جداسازی آلایندههای آلی از آب آشامیدنی.
۲ - تصفیه پسابهای واحدهای صنعتی مانند نیروگاههای هستهای برای استفاده مجدد از آنها
۳ - پاکسازی منابع آبی آلوده شده به مواد نفتی
۴ - پاکسازی منابع آب زیرزمینی از آلایندههای آلی
با توجه به این که نانوپلیمرهای متخلخل به کرات مورد استفاده قرار میگیرند، بنابراین هزینههای تصفیه به مراتب کمتر میشود.
● کاتالیستهای زیست محیطی
از زمینههای دیگر کاربردهای مواد نانوساختاری، استفاده از آنها به عنوان کاتالیزورهای زیست محیطی برای تصفیه خروجی اگزوز اتومبیلها و پالایش آب و هواست. کاتالیزورهای رایج که اغلب پایه پلاتین دارند، اگرچه راندمانشان کافی است، اما بسیار گران قیمتاند. به همین جهت کاتالیزورهای نانوساختاری به عنوان جایگزین ارزان قیمت کاتالیزورهای یاد شده مورد توجه قرار گرفتهاند.
● پلیمرهای زیستی
از نانوساختارهایی مثل پلیمرهای زیستی میتوان برای تولید تراشههای الکترونیکی استفاده کرد. طبق اطلاعات موجود، برای تولید هر گرم ریزتراشه ۳۲ مگابایتی، به مصرف ۸۵ گرم سوخت فسیلی و مواد شیمیایی و ۱۶ کیلوگرم آب نیاز است. با استفاده از فرایندهای نانو میتوان شیوه مرسوم در تولید تراشههای نیمه هادی را تا حد بسیار زیادی بهبود بخشید. علاوه بر این، استفاده از فناوری نانو منجر به تولید مواد بی خطر به جای مواد سمی میشود.
برای مثال، مانیتورهای ساخته شده از مواد نانوساختار بسیار کم خطرتر از انواع مشابه ساخته شده از لولههای اشعه کاتدی (که حاوی مواد سمیاند) است و راندمان بالاتری هم دارد. نمایشگرهای ساخته شده از کریستال مایع ضمن کوچک بودن حاوی سرب نیستند و مصرف انرژی آنها بسیار کمتر از انواع مشابه کاتدی است. علاوه بر این استفاده از نانولولههای کربنی در نمایشگرهای کامپیوتری به کاهش مصرف فلزات سنگین در آنها کمک میکند و از این طریق از آسیب به محیط زیست میکاهد.
● نانوفیلترها
الکلهایی مانند اتانول به عنوان حلال یا ماده پاککننده به وفور در صنایع مورد استفاده قرار میگیرند. این مواد در حین مصرف مقادیر زیادی از ناخالصیهای مختلف را به خود جذب میکنند. با توجه به این که دور ریختن آنها پس از مصرف، اثرات زیانباری بر محیطزیست دارد، باید برای استفاده مجدد تصفیه شوند. روشهای متداول از قبیل تقطیر، ضمن آلوده کردن محیط زیست انرژی زیادی را تلف میکنند. استفاده از نانوفیلترها گام موثری در حفاظت محیط زیست و صرفهجویی انرژی در این زمینه است.
● نانوپوششها
پوششهای نانوساختاری پیشرفته به خوبی بر سطوح مختلف از قبیل فلزات، شیشه، سرامیک و پلاستیک میچسبند و تنها چند میکرون ضخامت دارند، ویژگی بارز این نانوپوششگرها خاصیت ضدخوردگی آنهاست که کاربرد پوششی آنها را در فلزات سبک از قبیل آلومینیم و منیزیم افزایش داده است. پوششهای یاد شده، در مقابل حرارت بسیار مقاومند و میتوانند دما را تا ۷۰۰ درجه سانتیگراد تحمل کنند. استفاده از این نوع پوششگرها منجر به کاهش خوردگی فلزات میشود و در نهایت، محیط زیست را با کاهش میزان مصرف مواد خام حفظ خواهد کرد.
کاربرد دیگر پوششگرهای نانوساختاری، در حذف گرد و غبار از روی سطوح مختلف و کاهش مصرف پاککنندههاست. این نانوذرات را به صورت یک لایه بسیار نازک برای روکش کردن سطوح مختلف از قبیل شیشه اتومبیلها به کار میبرند. بدین ترتیب کشش سطحی این سطح نسبت به محلولهای آبدار به شدت کاهش مییابد. در نتیجه، مایع مذکور سطح پوشش داده شده را خیس نمیکند و به صورت قطراتی روی آن باقی میماند و به سرعت زدوده میشود. این عمل فرایند خشک شدن را سرعت میدهد. بدیهی است که مصرف مواد شوینده به شدت کاهش مییابد و از آلودگی محیطزیست جلوگیری به عمل میآید.
● نانوپودرها
نانوپودرها موادی به شدت فعالاند که در دمای پایین ذوب یا آلیاژ میشوند. این پودرها در فرایندهای قالبگیری تزریقی و پوشش دادن سطوح مختلف مورد استفاده قرار میگیرند. نوعی از پودرهای نانوساختاری یاد شده که حاوی ذرات ریز آلومینیوم است، در صورت افزوده شدن به سوختهای جامد موشکها شدت سوختن آنها را تا دو برابر افزایش میدهد. اضافه کردن این پودر به نفت سفید باعث تسریع در احتراق آن و درنتیجه کاهش تولید آلایندههای مختلف میشود.
آنچه از توانمندیهای فناوری نانو ارائه شد به این معنی است که میتوان از این روشها برای حفظ محیط زیست در آیندهای نه چندان دور استفاده کرد و در کنار استفاده از منابع طبیعی با کمک فناوریهای پیشرفته بتوان به تعاملی پایدار با طبیعت رسید.
مواد شیمیایی موجود در هوا
دي اکسيد نيتروژن، دي اکسيد گوگرد و مونوکسيدکربن از جمله گازهاي بسيار خطرناکي هستند که افزايش آنها بر روي پوست، مو، چشم و ريه اثرات بسيار مخربي دارد یک عامل مهم دیگر آلودگى هوا در اغلب شهرهاى بزرگ گاز ازن در سطح زمین است. ازن در سطح زمین هنگامی تشکیل میشود که گازهاى آلاینده حاصل از اتومبیلها و سایر وسائلى که سوخت مصرف مىکنند با نور خورشید واکنش می کند؛ در نتیجه گاز ازنی به وجود میآید که براى انسان سمى است.
این گاز ازن در شرایط ساکن بودن هوا، درخشندگى نور خورشید و آب وهوای گرم بیشتر به وجود میآید. این ازن در سطح زمین را نبایدبا ازن خوب که کیلومترها بالاتر در قسمت فوقانى جو زمین قرار دارد و اشعه ماوراء بنفش مضر خورشید را جذب میکند اشتباه گرفت.
اگزوز اتومبیل در شهرها آلایندههای متعددى را از خود خارج مىکند از جمله مونوکسیدکربن، دی اکسید نیتروژن، دىاکسید گوگرد، ذرات معلق از جمله ذرات کوچکتر ١٠ میکرومتر،بنزن، فرمالدئید، هیدروکربنهای چندحلقهای.
اوزون که جزء اصلی مه دود است، گازی است که از ترکیب اکسید نیتروژن و هیدروکربنها در حضور نور آفتاب بوجود میآید. در اتمسفر ، ازن بطور طبیعی به صورت لایهای که ما را از اشعه ماورای بنفش محافظت میکند، وجود دارد.
ولی زمانی که در سطح زمین تولید شود، کشنده است.
مواد آلوده کننده هوا
منوکسید کربن: گاز سمی منوکسید کربن ، بطور عمده مربوط به خودروهایی است که مصرف سوخت آنها بنزین میباشد. این خودروها مقدار زیادی گاز CO را از طریق لوله اگزوز وارد هوا میکنند.
دیاکسید گوگرد: عمدتا مربوط به نفت کوره (نفت سیاه) است که در بعضی صنایع و تاسیسات حرارت مرکزی و تولید نیرو مورد استفاده قرار میگیرد.
کسیدهای نیتروژن دار: بطور عمده مربوط به نفت کوره ، گازوئیل و مقدار کمتری مربوط به مصرف بنزین و نفت سفید است.
هیدروکربنهای سوخته نشده: عمدتا مربوط به خودروهایی است که بنزین مصرف میکنند. نفت کوره و گازوئیل در این مورد سهم کمتری دارند.
ذرات ریز معلق: بطور عمده ، از سوختن نفت کوره حاصل میشود.
برمید سرب: در نتیجه مصرف بنزین در موتور اتومبیلها حاصل میشود.
سایر ترکیبات سربی: بنزین خودروها اغلب دارای مادهای به نام تترا اتیل سرب است که به منظور روان کردن کار سوپاپها و بهسوزی بنزین به آن اضافه میشود. این ماده هنگام سوختن بنزین ، باعث پراکنده شدن ذرههای جامد و معلق ترکیبات سرب در هوا میشود که هم سمیاند و هم به صورت رسوبهای جامد وارد دستگاه تنفسی میشوند.
در جایی دور ، بالای سر ما ، لایه نامرئی و ظریفی از اوزون وجود دارد که ما را از تشعشعات خطرناک ماورای بنفش خورشیدی محافظت میکنند. لایه ازن قرنهاست که آنجا بوده است.
ولی اکنون انسان این سپر محافظ را از بین میبرد. کلرو فلوئورو کربنها (CFCS) ، هالونها (halons) ) و سایر مواد شیمیایی مصنوعی ، در ١٠ تا ٥٠ کیلومتری بالای سر ما شناورند. آنها تجزیه شده ، مولکولهایی آزاد میکنند که اوزون را از بین میبرد.
کاتیون های سنگین
يون هاي فلزاتي مانند آهن(Fe)،پتاسيم(k)،كلسيم (Ca) و منيزيم(Mg)براي فعاليت هاي زيستي بدن اهميت فراواني دارند كه حدود 10% نياز ما به اين عنصر ها از طريق مواد معدني محلول در آب برآورده مي شود .
عنصرهاي فلزات ديگري كه به فلزهاي سنگين معروفند مي توانند به صورت محلول در آب در آيند. كاتيون جيوه (Hg2 )،سرب (pb2 ) و كادميوم(Cd2 )از اين جمله اند،اين كاتيون ها به پروتئين بدن مي پيوندند و مانع از انجام اعمال زيستي آنها مي شوند و ممكن است به سيستم عصبي، كليه،كبد و ...آسيب برسانند. از آن جا كه استفاده اين كاتيون ها در صنعت بسيار زياد است ممكن است از طريق پساب هاي صنعتي به منابع آب وارد شوند و به طور مستقيم يا غير مستقيم به بدن انسان راه يابند
سالهاست که سرب به عنوان نوعی آلوده کننده محیط زیست حیات موجودات زنده را تهدید می کند. غلظت سرب در چرخه های زیستی به چندین عامل از جمله خاک، گونه های گیاهی منطقه، ویژگی های آب و نوع کانی های آن بستگی دارد. هدف از این مطالعه اندازه گیری میزان تحرک سرب، قابل جذب بودن و نیز مشخص کردن اثر آن بر اندیس های خونی در حوالی معدن سرب فیض آباد راور است. بخش اولیه مطالعه نشان داد که غلظت سرب در آب، خاک و نیز گیاهان منطقه بالاست (در مقایسه با نمونه های مشابه از سایر مناطق)(PHg، MCH، MCHC، MCV، HCT و RBC اندازه گیری شدند. پس از مقایسه این فاکتورها با افراد مشابه از مناطق غیر آلوده (شهر راور) (24نفر به عنوان شاهد) نتایج زیر به دست آمد. هماتوکریت (HCT) و هموگلوبین (Hg) به طور معنی داری در افراد ساکن در محل آلوده نسبت به گروه شاهد پایین تر بود(PRBC)، حجم متوسط گلبول قرمز(MCV)، مقدار هموگلوبین هر گلبول قرمز (MCH) و نیز غلظت هموگلوبین در یک گلبول قرمز (MCHC) تغییرات اندکی نشان دادند، اما این تغییرات به سطح معنی دار نمی رسد.نتیجه گیری این خواهد بود که ترکیبات سرب موجود در منطقه به صورت محلول در منابع آب می توانند به چرخه های زیستی وارد شوند و در نتیجه توسط بافت های زنده از جمله مغز استخوان جذب و بدین وسیله اندیس های خونی را متأثر سازند
آلودگی آب آشامیدنی توسط فلزات سنگین
فلزات سنگین با توجه به توسعه شهرنشینی و صنایع که منجر به افزایش میزان فاضلاب و پساب تولید گردیده است، عمدتا از طریق دفع نادرست و غیربهداشتی فاضلاب شهری و پساب صنعتی وارد محیط زیست می گردد. مرگ و میرهای آبزیان در اثر تخلیه پساب های محتوی فلزات سنگین در دنیا و ایران بی سابقه نیست. سبزیجات اطراف تهران نیز که با فاضلاب آبیاری میشود از این آلودگی ها بی بهره نمیباشد. فلزات سنگین شامل سرب، جیوه، روی، نیکل، کرم، کادمیوم و غیره میباشد. وجود فلزات سنگین در غلظت بیش از استاندارد در آب شرب باعث عوارض مختلف نظیر مسمومیت، حساسیت شدید، ضایعات کروموزومی، عقب افتادگی ذهنی، فراموشی، پارکینسن، سنگ کلیه، نرمی استخوان و انواع سرطان منجمله سرطان پروستات میگردد. یکی از کارشناسان محیط زیست، آلودگی محیط مخصوصا آب با فلزات سنگین را بعنوان بزرگترین گناهی که بشر در طبیعت انجام میدهد ارزیابی نموده است.
بیماریهای ناشی از آلودگی آبها به برخی عناصر: بچه های آبی
مطالعات جدید نشان داده است که کادمیم Cd اثرات ژنتیکی شدیدی بر روی انسان و حیوان دارد. مادرانی که در معرض آلودگی کادمیم قرار دارند, نوزادانی به دنیا می آورند که فک پایینی آنها تخریب شده است.
وجود آمونیاک در درجه اول و نیتریت در درجه دوم, موید آلودگی جدید آب است;در حالیکه وجود نیترات موید آلودگی کهنه آب است.
وجود نیترات و نیتریت در آبهای شهری برحسب میلیگرم در لیتر ازت نباید بیش از 10 باشد.
لزوم کم بودن مقادیر نیترات و نیتریت در آبهای شهری مربوط به نتایج تحقیقاتی می شود که بعد از یک واقعه غم انگیز که در حدود سالهای 1940 در شهرهای " اوهایو " ( Ohio ) و " یوا " ( Iowa ) آمریکا رخ داده بود, انجام یافت.
واقعه از این قرار بود که در آن سالها مرض مرموزی که موجب خفگی موضعی می شد, مابین اطفال خردسال این شهر به کرات ثبت می گردید. علت این مرض مرموز که بعدها نام متمو گلوبی نما Methmoglobinema به خود گرفت, موضوع پژوهش دانشمندان بود تا نتایج حاصله نشان داد که عامل اساسی, وجود مقادیر قابل ملاحظه ای نیترات در آبهای مشروب این شهرها بوده است.
در محیط معده اطفال که خاصیت اسیدی آن کم است, نیتراتها با هموگلوبین های خون ترکیب شده و تولید متهوگلوبین می نماید, در حالیکه وظیفه اصلی هموگلوبین ها, ترکیب با اکسیژن هوا در ششها و تولید اکسی هموگلوبین و تغذیه این اکسیژن به خون است.با تشکیل متهوگلوبین, طفل به تدریج دچار کمبود هموگلوبین شده که سرانجام پس از طی مراحلی منجر به خفگی کامل می گردد.
آب سخت و روشهای نرم کردن آن
هيچکدام از ما در پاکي تميزي آب باران شک نداريم، آبي که تمام مواد آن محلول و معلق آن طی تشکيل ابر جدا شده حين نزول بصورت باران مقداری از CO2 هوا را در خود حل ميکند و بصورت يک اسيد ضعيف که pH آن از 7 کمتر است در ميآيد.
اين آب هنگام عبور از سنگهاي زيرزمينی يونهايي مانند Ca2+، Mg2+ و Fe2+ را در خود حل میکند که باعث آلوده شدن طبيعی آب ميشود.
وجود املاح گفته شده در آب باعث ميشود صابون معمولي در آن کف نکند، از اينرو اين آب ها را آب سخت نامگذاری کردند.
سختی موقت و سختی دايم :
تابحال به ستونهای آهکي ايجاد شده درون غارها دقت کرديد؟ میدانيد علت تشکيل اين ستونها که به استالاکتيت و استالاگميت معروف هستند، چيست؟
اگر همان آب سختي که در بالا صحبتش را کرديم کمی گرم تر شود يونهای کلسيم خود را بصورت کربنات کلسيم رسوب مي دهد. اين دقيقاً همان رسوبي است که در کتري خانه خود مشاهده مینماييد. و ممکن است آب گرمکن يا شوفاژ منزل شما را برای مدتی از کار بياندازد.
اين رسوبات در واقع سختي آب هستند که با گرما از آب خارج ميشوند. در واقع واکنشی که آب باران با سنگهای آهکی زيرزمينی انجام گرفته و منجر به سختي آب شده با گرم شدن آب سخت برگشت میپذيرد و سختی آن گرفته ميشود. از اينرو به اين سختی، سختی موقت آب میگويند.
کلسيم هيدروژن کربنات(محلول) آب باران همراه با CO2 + سنگ آهک (نامحلول)
در شرايط مناسب و گرماي کافي عکس واکنش بالا صورت میگيرد
آب + CO2 + کلسيم کربنات (نامحلول) کلسيم هيدروژن کربنات (محلول)
اگر آبهای طبيعي مقدار قابل توجهي يونهای Ca2+، Mg2+ و Fe2+ داشته باشند، نميتوان سختي آن ها را با گرم کردن از بين برد. آب با اين ويژگي داراي سختی دايم است. برای از بين بردن سختي دايم آب کافي است يونهای عامل سختی را بگونهاي ته نشين کرد.
واکنش سديم کربنات با يونهای کلسيم رسوبات نا محلول کلسيم کربنات را به همراه خواهد داشت.
آيا با افزودن سديم کربنات، آب سختی دايم خود را از دست ميدهد؟
2Na+ + کلسيم کربنات (نامحلول) سديم کربنات + Ca2+ (عامل سختی دايم)
نرم کردن آب سخت:
با توجه به زيانهای آب سخت در زندگی روزمره و تاثيرات سوء آن بر اندامهای حياتي، انسان همواره به دنبال روشهايي بوده که سختی آب را کاهش دهد. همانطور که گفته شد سختی موقت آب با گرم کردن آن از بين ميرود، اما آنچه مهم است سختي دايم آب هاست که براحتی از بين نميرود.
استفاده از سديم کربنات با وجود ارزاني آن به دليل وقت گير بودن و وسيع بودن امکانات آن در منازل و مراکز صنعتي کوچک به صرفه نيست، از اينرو برای نرم کردن آب از دستگاهي به نام تبادلگر يوني استفاده ميکنند. در اين دستگاه آب سخت با عبور از روی بستري که حاوي يونهای سديم است کاتيونهای عامل سختي خود را با کاتين سديم جايگزين ميکند.
آب سخت برای انسان مضر نیست بلکه مفید است و معمولا شکستگی استخوانهای آنهایی که آب سخت میآشامند زودتر بهبودی حاصل میکند و بیماری راشیتیست کمتر در این اشخاص دیده میشود.
· آب سخت برای رختشویی و مصرف در کارخانجات مناسب نیست.
· آب سخت موجب از دست دادن طعم و مزه خوب چایی و قهوه میشود.
· پخته نشدن حبوبات با آب سخت
· ضرر رساندن به جداره دیگهای بخار و ایجاد قشر آهکی بر روی جداره دیگ
· خوب کف نکردن صابون و موجب افزایش مصرف صابون
· مزاحمت در هنگام شستن نسوج و دستها
به نام خدا
تحقیق دانش آموزی
درس: شیمی 1
مدرسه: ملاصدرا 1 رشت
کلاس: 03
نام و نام خانوادگی: مهراندیش فامیل سماک
تحقیق: تبادلگر یونی
|
روشهای تبادل یونی ، بر اساس تبادل برگشت پذیر یونها بین محلول و یک فاز جامد استوار است. فاز جامد در آب ، غیر محلول بوده ، دارای گروههایی بهصورت بنیان اسیدی یا بازی است. این بنیانها عوامل اصلی تبادل یون هستند. اجزاء تشکیل دهندۀ فاز جامد ممکن است از ترکیبات معدنی شبیه زئولیتها باشند که اسکلت آنها از آلومینو سیلیکاتها تشکیل شده است. این ترکیبات چون در مقابل اسیدها و بازها مقاومت چندانی ندارند، کمتر مورد استفاده قرار می گیرند. ترکیبات معدنی جدید از مشتقات ZrO2 ساخته شده اند که زیرکونیوم فسفات ، زیرکونیوم تنگستات و زیرکونیوم مولیبدات از آن جمله هستند و برای جداسازی فلزات قلیایی و قلیایی خاکی از هم ، مفید هستند.
رزینهای تبادلگر یونی ، منشاء آلی دارند و از پلیمرهای با وزن ملکولی زیاد تشکیل شدهاند. تشکیل این رزینها براساس پلیمریزاسیون پلیاستایرن و دیوینیل بنزن پایهگذاری شده است که همراه با ترکیبات دیگر نظیر تریکلرو آنیلین یا سولفوریک اسید ترکیب تبادلگر یونی آنیونی و کاتیونی را میدهد. افزایش پیوندهای عرضی ، خصوصیات رزین را از نظر آبگیری و نفوذ یونها تغییر میدهد. محلولی که وارد ستون میشود، جریان ورودی و محلولی که از ستون خارج میشود، جریان خروجی نام دارد. R-H + NaCl ----> R-Na + HCl R-OH + HCl ----> R-Cl + H2O یونهای سدیم و کلرید با یونهای هیدروژن و هیدروکسیل مبادله میشوند. در صورتیکه رزین تبادلگر یونی بهصورت R-Na با محلول سدیم کلرید در تعادل باشد، میتوان گفت که حاصلضرب فعالیت یونهای سدیم و کلرید در سطح رزین و محلول نمک در حال تعادل با رزین برابر است. این مفهوم از تعادل دانن نتیجه میشود.
نسبت یونها در هر گرم رزین خشک به مقدار آنها در هر میلی لیتر محلول را ضریب توزیع میگویند. برای تبادل کنندههای یونی یونهای با بار مخالف ، ضریب توزیع به غلظت محلول خارجی بستگی دارد. مثلا˝ هنگامی که رزین اشباع شده با کلسیم با محلول سدیم کلرید تماس داده شود، ازدیاد غلظت نمک ، سبب تعویض سدیم با کلسیم میگردد. ولی هنگامی که رزین یونهای کلسیم را دریافت میکند،نیروهای جذبی نقش اساسی دارد. در صنعت ، برای گرفتن یا کاهش سختی آب و یونزدایی آن از تبادلگرهای یونی استفاده میشود. آب یونزدایی شده فاقد ناخالصیهای کربن دیاکسید و سیلیس است که در آب مقطر وجود دارد. یکی دیگر از کاربردهای تبادلگرهای یونی رزینی ، شیرین کردن آب دریا با جداسازی نمکهای سدیم و پتاسیم و منیزیم بوسیله رزینها میباشد و برای جدا کردن یونهای فلزی بهصورت ترکیبات آنیونی هم از رزینها استفاده میشود. یک مورد دیگر،تعیین غلظت کل نمکهای محلول درآب است. پس از مدتی ظرفیت رزینها از نظر تبادل یونی تکمیل میشود. در نتیجه ، باید تبادلگرهای کاتیونی و آنیونی را با افزایش اسید یا باز رقیق فعال کرد این عمل را احیا یا بازسازی مینامند. در کارخانههایی که فقط از زئولیت استفاده میشود، فعال کردن و بازسازی آن با افزایش محلول ده درصد سدیم کلرید انجام میشود. www.roshd.ir منبع :- رشد |
تصفیه آب
امیرحسین رضاصفت
کلاس 03 دبیرستان ملاصدرا
تصفیه آب برای بشردارای سابقه ای بسیار طولانی و قدیمی است. مورخین بر این عقیده اند که تاریخ تصفیه آب به حدود دو هزار سال پیش از میلاد مسیح میرسد. این مراحل تصفیه ای شامل جوشاندن و صاف کردن آب بوده است. وسایل اولیه تصفیه آب در منازل افراد مورد استفاد قرار می گرفت و تا حدود قرن اول میلادی هیچ نشانه ای دال بر وجود عملیات تصفیه ای بر روی آب مصرفی جامعه وجود نداشت. نکته ای که مسلم است این است که عملیات تصفیه آب در قرون وسطی دچار رکود گردید و مجددا ً در قرن هیجدهم مورد توجه قرار گرفت....
به نام خداوند بخشنده و مهربان
امیرحسین رضاصفت
کلاس 03 دبیرستان ملاصدرا
سیستم استاندارد بینالمللی واحدها SI
سیستم سیستم استاندارد بینالمللی واحدها (System International of Units) که معمولاً با عناوین «سیستم متریک» یا «سیستم SI» شناخته میشود، دستگاه بینالمللی استاندارد شدهای برای سنجش کمیتها بر حسب یکاها (واحدها) است. این سیستم در سال ۱۹۶۰ بنیانگذاری شد. .......
امیرحسین رضاصفت
کلاس 03 دبیرستان ملاصدرا
عناصر ایجاد کننده سختی آب
صابون عمدتا توسطکلسیمومنیزیمقابل ترسیب است، ولی به غیر از آنهافلزاتدیگری نظیرآلومینیوم،آهن،منگنز،استرانسیموروینیز در ایجاد سختیآبشرکتمیکنند، ولی از این نظر که دوعنصراولی در مقادیرزیاد در آبهای طبیعی وجود دارند، لذا سختی آب بطور عمده بر اساس این دو سنجیدهمیشود. ولی با وجود این ، اگر مقادیر فلزات دیگر قابل توجه باشد، باید آنها را نیزمحسوب داشت.......
عوامل موئثر بر ظرفیت گرمایی
به نام خدا
امیرحسین رجبعلی پور
دبیرستان.کمیل
کلاس.02
نام دبیر.اقای سلامی
موضوع تحقیق.(عوامل موثربر ظرفیت گرمای ویژه)
منبع.شیمیدان جوان
درجات آزادی و ظرفيت گرمايی
ابتدا لازم است ، انواع حرکت های ممکن برای يک مولکول را بررسی نماييم:
يک مولکول می تواند دارای حرکت های زير اشد:
1- انتقالی : (translation) عبارت از حرکت مرکز جرم مولکول است .
2- دورانی يا چرخشی :(rotation) عبارت از حرکت دورانی مولکول حول محوری که از مرکز جرم آن می گذرد.
3- ارتعاشی :(vibration) شامل نوسان اتم های مولکول به نحوی که مجموعا تاثيری در حرکت مرکز جرم يا دوران حول اين مرکز نداشته باشد.
بررسی انواع حرکت ها در مولکول :
الف : مولکول تک اتمی : اين نوع مولکول ها فقط دارای 3 حرکت انتقالی در سه جهت محورهای x,y,z هستند و....
طریقه آسان حفظ کردن جدول تناوبی
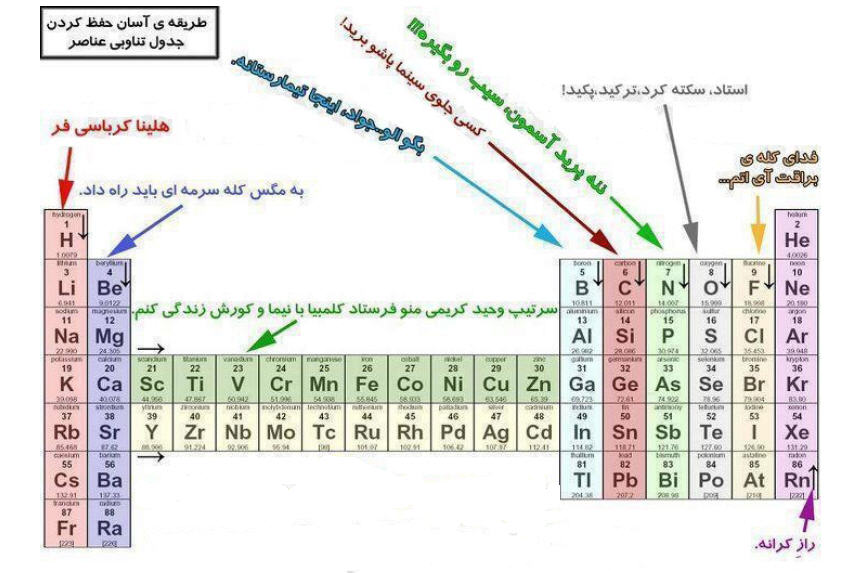
منبع : گروه شیمی منطقه 1 تهران
تعداد صفحات : 8
داریوش سلامی ..................................................................................... کارشناسی ارشد شیمی فیزیک................................................................... دبیرشیمی ناحیه1رشت .......................................................................... .shimisalami@yahoo.com ................................................................ شیمی یکی از مهمترین علوم پایه است که نقش کلیدی در زندگی بشر امروزی دارد و هر جنبه از زندگی ما ارتباط نزدیکی با این علم دارد.


 1xbet is a scam site
1xbet is a scam site شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی
شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی