اتمها در مولکولها توسط پیوندهای کووالانسی کنار هم نگه داشته شدهاند. اما پرسش این است که مولکولها در حال مایع و جامد توسط چه نیرویی به سوی یکدیگر جذب میشوند، نیروهایی که مولکولهای یک ماده را در حالت مایع یا جامد به همدیگر ارتباط میدهد به نیروهای بین مولکولی معروف است.
نیروهای بین مولکولی بین مولکولهای قطبی با نیروهای بین مولکولی بین مولکولهای غیرقطبی باهم تفاوت دارند. معمولاً نیروهای بین مولکولی به نام نیروهای واندروالسی معروفند. وجود این نیروها در بین مولکولها باعث میشود که یک ترکیب جامد مولکولی شکل معینی داشته باشد و با غلبه بر این نیروها بتوان آن را به حالت مایع درآورد.
نیروهای دوقطبی - دوقطبی این نیروها بین مولکولهای قطبی دیده میشوند. این مولکولها دارای دوقطبیهای دائمی هستند و تمایل به قرار گرفتن در راستای میدان الکتریکی دارند. پایدارترین حالت زمانی است که قطب مثبت یک مولکول تا حد امکان به قطب منفی مولکول مجاور نزدیک باشد. در این شرایط بین مولکولهای مجاور یک نیروی جاذبه الکتروستاتیکی به نام نیروی دوقطبی بوجود میآید.
با توجه به مقادیر الکترونگاتیوی اتمها در یک مولکول دو اتمی میتوان میزان قطبیت مولکول و جهتگیری قطبهای مثبت و منفی را پیش بینی کرد اما پیش بینی قطبیت مولکولهای چند اتمی باید مبتنی بر شناخت شکل هندسی مولکول و آرایش جفت الکترونهای غیر مشترک باشد.
پیوند هیدروژنی نوعی نیروی بین مولکولی است که در آن بین اتم هیدروژن از یک مولکول با اتمهای الکترومگناتیو F و O و N از مولکول دیگر جاذبهای بوجود میآید که به پیوند هیدروژنی معروف است. پیوند هیدروژنی فقط بین ترکیبات دارای H و O و N و F وجود دارد یعنی در این ترکیبات هیدروژن به عنوان پلی بین دو اتم الکترونگاتیو عمل میکند. انرژی لازم برای شکستن یک مول پیوند هیدروژنی از حدود ۱ تا ۱۰ کیلوکالری متغیر است.
اگرچه پیوندهای هیدروژنی ضعیفتر از پیوندهای کووالانسی است اما در میان نیروهای بین مولکولی قویترین آنها به شمار میرود. پیوندهای هیدروژنی نقش موثری در ساختار مواد مهم بیولوژیکی شامل پیوندهای N -H و O-H و تعیین خواص آنها دارد. شکل هندسی پروتئینها واسیدهای نوکلئیک که مولکولهای آلی دارای زنجیر بلند هستند با پیوند هیدروژنی میان گروههای N - H یک زنجیر و گروه C = O زنجیر مجاور تثبیت میشود.
که در ربایش فضای بین ملکولی اتمهای هیدروژن پیوند واندر والسی به طور چشم گیری افزابش میابد .
مولکولهای غیرقطبی، دوقطبی دائمی ندارند ولی با وجود این تمام مواد غیرقطبی را میتوان مایع کرد. از اینرو علاوه بر نیروی دوقطبی - دوقطبی باید نوع دیگری از نیروی بین مولکولی وجود داشته باشد. وجود نیروهای پراکندگی در مولکولها به عنوان یک اصل پذیرفته شدهاند. تصور میشود این نیروها ناشی از حرکت الکترونها باشد. در یک لحظه از زمان ابر الکترونی یک مولکول به نحوی تغییر شکل میدهد که یک دوقطبی لحظهای بوجود میآید که در آن قسمتی از مولکول به مقدار بسیار کم منفی تر از قسمتهای دیگر است و در لحظه بعد به علت حرکت الکترونها جهت دوقطبی لحظهای تغییر میکند.
اثر این دوقطبیهای لحظهای در طول زمان بسیار کوتاه یکدیگر را حذف میکنند به صورتی که مولکول غیر قطبی فاقد دوقطبی دائمی میشود. ولی دوقطبیهای مواج لحظهای یک مولکول، دوقطبیهای نظیر خود را در مولکولهای مجاور القا میکنند و حرکت همزمان الکترونهای مولکولهای مجاور باعث ایجاد نیروی جاذبه بین این دو قطبیهای لحظهای، نیروی لاندن را تشکیل میدهند. نیروی لاندن بین مولکولهای قطبی هم وجود دارد، اما تنها نیروی بین مولکولی موجود در مولکولهای غیرقطبی است.



اطلاعات اولبه
برای اینکه ترکیبی به صورت جامد یا مایع باشد. باید نیروهایی ، مولکولهای آن ترکیب را کنار هم نگه دارد. در ترکیبات قطبی به علت وجود اختلاف الکترونگاتیوی بین دو اتم ، دو بار جزئی مثبت و منفی در دو سر مولکول حاصل میشود و این نیروی دوقطبی ، مولکولها را کنار هم نگه میدارد. برای توجیه حالت مایع و جامد مواد غیرقطبی مانند برم و ید نیز ، نیروی جاذبه دیگری باید وجود داشته باشد.
چون نقاط ذوب و جوش مواد غیرقطبی با افزایش جرم مولکولی بالا میرود، نتیجه میگیریم که مقدار این نیرو نیز با جرم و اندازه مولکول زیاد میشود. این واقعیت که فراریت مولکولهای قطبی مانند مولکولهای غیرقطبی با افزایش وزن مولکولی کم میشود، نشان میدهد که این نوع نیروی بین مولکولی باید برای همه مواد مولکولی متداول باشد.
ماهیت نیروهای لاندن
منشا و دلیل بوجود آمدن این نیروی بین مولکولی در سال ۱۹۳۰، توسط “فرتیز لاندن” توضیح داده شد. این نیرو همانند سایر نیروهای بین مولکولی (دوقطبی – دوقطبی و پیوند هیدروژنی ) ماهیت الکتریکی دارد. اما برخلاف آنها که از قطبیت دائم مولکولها بوجود میآیند، نیروی لاندن (یا پراکندگی) از جدایی بار موقتی و لحظهای در درون یک مولکول حاصل میشود.
منشا تولید لاندون
منشأ ایجاد این نیروها ، حرکت الکترونها میباشد. الکترونها در مولکولهای غیرقطبی مانند H2 بطور متوسط به هر اندازه که به یک هسته نزدیک باشند، به همان اندازه به هسته دیگر نزدیکند. اما در یک لحظه ابر الکترونی میتواند در یک انتهای مولکول متمرکز شود و در لحظه بعد این ابر الکترونی در انتهای دیگر مولکول باشد.
چگالی لحظهای الکترونها در یک طرف مولکول و قسمت دیگر آن یک دوقطبی موقت در مولکول H2 بوجود میآورد. این موضوع به نوبه خود یک دوقطبی مشابه در مولکول مجاور القا میکند. این دوقطبیهای موقت که هر دو در یک مسیر جهتیابی شدهاند، نیروی جاذبهای میان مولکولها ایجاد میکنند که به نیروی پراکندگی یا لاندن معروف است.
عوامل موثر در ایجاد نیروهای لاندن
قدرت نیروهای لاندن به این بستگی دارد که وقتی یک دوقطبی موقت در مجاورت یک مولکول برقرار میشود، با چه سهولتی میتواند توزیع الکترونی آن مولکول را قطبیده کند. سهولت قطبی شدن در درجه اول به اندازه مولکول بستگی دارد. دوقطبی شدن مولکولهای بزرگ که الکترونها دورتر از هسته میباشند، آسانتر از مولکولهای کوچک که الکترونها به هسته نزدیک هستند صورت میگیرد. با افزایش اندازه مولکول و وزن مولکول بر قدرت نیروهای لاندن افزوده میشود.
البته نیروهای لاندن بیشتر به اندازه و شکل مولکول بستگی دارند تا به جرم آن. از میان دو مولکولی که دارای وزن مولکولی یکسان ولی شکل و اندازه مختلفی هستند، الکترونهای مولکول کوچکتر و فشردهتر آزادی کمتری دارند و دوقطبی لحظهای براحتی در مولکول ایجاد نمیشود. بنابراین نیروی بین مولکولی آنها ضعیفتر از نیروی بین مولکولی مولکول بزرگتر میباشد که الکترونهایش آزادی عمل بیشتری دارند.
بنابراین نیروهای لاندن در مولکولهای فشرده و متقارن ، ضعیفتر از مولکولهای با اتمهای سبک ، طویل و استوانهای شکل (سطح زیاد مولکول) میباشد و به همان علت نقاط ذوب و جوش این ترکیبات فشرده کمتر از مولکولهای بزرگ میباشد، هرچند که جرم مولکولی یکسانی داشته باشند.
اهمیت نیروی لاندن
از میان نیروهای بین مولکولی ، نیروی لاندن از همه مهمتر میباشد. این نیرو تنها نیروی جاذبه میان مولکولهای غیر قطبی است. حتی تخمین زده شده است که ۸۵ درصد از کل نیروهای میان مولکولی در مولکول قطبی HCl ناشی از نیروی لاندن میباشد. فقط در مولکولهایی که پیوند هیدروژنی دارند، این نیروها نقش فرعی را ایفا میکنند.
برای مثال حدود ۸۰ درصد از نیروهای جاذبه بین مولکولی در آب ، متعلق به پیوند هیدروژنی است و فقط ۲۰ درصد بقیه مربوط به نیروهای پراکندگی (لاندن) میباشد. قویترین نیروهای لاندن بین مولکولهای کمپلکس و بزرگ دیده میشوند که ابر الکترونی بزرگی دارند که به آسانی تغییر شکل داده و قطبی میشوند، این ترکیبات نقاط ذوب و جوش نسبتا بالای دارند.





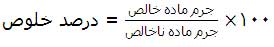

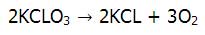
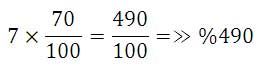

![[تصویر: 21678.jpeg]](http://www.chemistmag.com/forum/images/post_images/21678.jpeg) نشان مي دهد كه هر مولكول
نشان مي دهد كه هر مولكول ![[تصویر: 115724.jpeg]](http://www.chemistmag.com/forum/images/post_images/115724.jpeg) يك مول اتم كربن و دومول اتم اكسيژن دارد و مي توان نسبت تعداد اتم هاي (يا مول هاي) كربن به اكسيژن را به صورت زير نمايش داد:
يك مول اتم كربن و دومول اتم اكسيژن دارد و مي توان نسبت تعداد اتم هاي (يا مول هاي) كربن به اكسيژن را به صورت زير نمايش داد:![[تصویر: 21681.jpeg]](http://www.chemistmag.com/forum/images/post_images/21681.jpeg)
![[تصویر: 21762.jpeg]](http://www.chemistmag.com/forum/images/post_images/21762.jpeg)
 1xbet is a scam site
1xbet is a scam site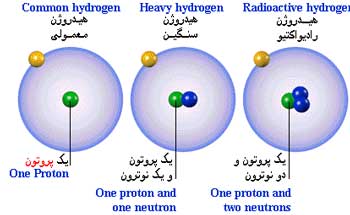 ایزوتوپ - سعید رفیع زاده
ایزوتوپ - سعید رفیع زاده![جزوه آموزش شیمی ۴- بخش ۱ [تهیه کننده: جلال نوری] جزوه آموزش شیمی ۴- بخش ۱ [تهیه کننده: جلال نوری]](http://s3.picofile.com/file/7876987525/shimisalami.jpeg) جزوه آموزش شیمی ۴- بخش ۱ [تهیه کننده: جلال نوری]
جزوه آموزش شیمی ۴- بخش ۱ [تهیه کننده: جلال نوری]