مهدی هادی پور/مدرسه شهید نصیری/کلاس05
امواج الکترومغناطیسی
دید کلی
در مکانیک کلاسیک و ترمودینامیک تلاش ما بر این است که کوتاهترین وجمع و جورترین معادلات یا قوانین را که یک موضع را تا حد امکان بطور کامل تعریف میکنند معرفی کنیم. در مکانیک به قوانین حرکت نیوتن و قوانین وابسته به آنها ، مانند قانون گرانش نیوتن، و در ترمودینامیک به سه قانون اساسی ترمودینامیکرسیدیم. در مورد الکترومغناطیس ، معادلات ماکسول به عنوان مبنا تعریف میشود. به عبارت دیگر میتوان گفت که معادلات ماکسول توصیف کاملی از الکترومغناطیس بدست میدهد و علاوه برآن اپتیک را به صورت جزء مکمل الکترومغناطیس پایه گذاری میکند. به ویژه این معادلات به ما امکان خواهد داد تا ثابت کنیم که سرعت نور در فضای آزاد طبق رابطه (C = 1/√μ0 ε0) به الکترومغناطیس|کمیتهای صرفا الکتریکی و مغناطیسی مربوط میشود.
یکی از نتایج بسیار مهم معادلات ماکسول ، مفهوم طیف الکترومغناطیسی است که حاصل کشف تجربی موج رادیویی است. قسمت عمده فیزیک امواج الکترومغناطیسی را از چشمههای ماورای زمین دریافت میکنیم و در واقع همه آگاهیهای که درباره جهان داریم از این طریق به ما میرسد. بدیهی است که فیزیک امواج الکترومغناطیسی خارج از زمین در گسترده نور مرئی از آغاز خلقت بشر مشاهده شدهاند.
 |
تعریف امواج الکترومغناطیسی
امواج الکترومغناطیسی یک رده از امواج است که دارای مشخصات زیر است:
- امواج الکترومغناطیسی دارای ماهیت و سرعت یکسان هستند و فقط از لحاظ فرکانس ، یا طول موج باهم تفاوت دارند
- در طیف امواج الکترومغناطیس هیچ شکافی وجود ندارد. یعنی هر فرکانس دلخواه را میتوانیم تولید کنیم.
- برای مقیاسهای بسامد یا طول موج ، هیچ حد بالا یا پائین تعیین شدهای وجود ندارد.
- از جمله منابع زمینی امواج الکترومغناطیسی میتوان به امواج دستگاه رله تلفن ، چراغهای روشنایی و نظایر آن اشاره کرد.
- این امواج برای انتشار خود نیاز به محیط مادی ندارند.
- قسمت عمده این فیزیک امواج دارای منبع فرازمینی هستند.
- امواج الکترومغناطیسی جزو امواج عرضی هستند.
گستره امواج الکترومغناطیسی
امواج الکترومغناطیسی از طولانیترین موج رادیویی ، با طول موجهای معادل چندین کیلومتر ، شروع شده پس از گذر از موج رادیویی متوسط و کوتاه تا نواحی کهموج ، فروسرخ و مرئی امتداد مییابد. بعد از ناحیه مرئی فرابنفش قرار دارد که خود منتهی به نواحی اشعه ایکس ، اشعه گاما و اشعه کیهانی میشود. نموداری از این طیف که در آن نواحی قراردادی طیفی نشان داده میشوند در شکل آمده است که این تقسیم بندیها جز برای ناحیه دقیقا تعریف شده مرئی لزوما اختیاریاند.
 |
یکاهای معروف فیزیک امواج الکترومغناطیسی
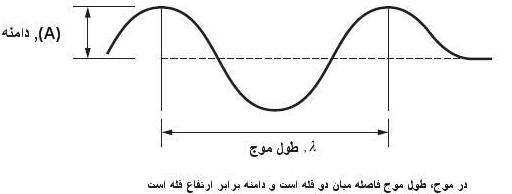
- طول موج λ بنا به تناسب مورد ، برحسب متر و همچنین میکرون یا میکرومتر μm ، واحد آنگستروم A و واحد ایکس XU نشان داده میشود.
- با بکار بردن متر به عنوان واحد طول ، طول موجهای نوری بایستی بنا به تناسب برحسب ، nm سنجیده شوند، ولی هنوز آنگستروم یک واحد رسمی بوده و به عنوان متداول ترین واحد درطیف نمایی بکار برده میشود.
- واحد XU ابتدا به شکل مستقل طوری تعریف شده بود که رابطه آن با آنگستروم به صورت 1A = XU 1002.060بود. این واحد اکنون دقیقا معادل 10-10 یا m 10-13 تعریف شده است.
- علی رغم طبقه بندی عمومی تابش با طول موج ، کمیت مهم از نظر ساختار اتمی و مولکولی فرکانس <ν = c/λvacΔE = hv به اختلاف انرژی ΔE بین دو حالت ساکن دستگاه مربوط است. در طول موجهای کوتاهتر مناسبتر آن است که به جای ν واحد متناسب با آن یعنی عدد موجیδ = 1/λvac = c/v جایگزین شود. مؤلفین مختلف واحدهای مختلفی را برای عدد موجیمانند ΄ν ، K و δ بکار میبرند که همگی یکساناند، در این بحث علامت δ انتخاب شده است، زیرا امکان اشتباه آن با خود ν و یا سایر ثابتها کم است.
- واحد عدد موجی یک بر سانتیمتر است که گاهی کایزر (K) نامیده میشود. واحد کوچکتر آن میلی کایزر است که (mk) واحد مناسبی برای ساختار فوق ریز و کارهای مربوط به عرض خطی است. هر چند که متخصصین طیف نمایی فرکانس رادیویی برای این قبیل کمیتها واحد فرکانس یعنی MHz را بکار میبرند (MHz 29.979=mk 1 ).
- انرژی موج را بر حسب واحد الکترون ولت (ev) بیان میکنند که انرژیهای فوتونی خیلی بالا (مربوط به طول موجهای خیلی کوتاه) یک الکترون ولت معادل 1.6x10-19J است.
طیف نمایی و امواج الکترومغناطیسی
- ناحیه مرئی یا نور مرئی (4000-7500 آنگستروم) توسط نواحی فروسرخ از طرف طول موجهای بلند ، فرابنفش از طرف طول موجهای کوتاه ، محصور شده است. معمولا این نواحی به قسمتهای فروسرخ و فرابنفش دور و نزدیک ، با محدودههایی به ترتیب در حدود 30 میکرومتر و 2000 آنگستروم تقسیم میشوند که نواحی مزبور دارای شفافیت نوری برای موادی شفاف از جمله منشورها و عدسیها میباشند.
- تا این اواخر ناحیه مرئی متشکل از فروسرخ تا فرابنفش نور توسط گافهایی از نواحی رادیویی و اشعه ایکس سوا میشدند که در آنها بر انگیزش و آشکار سازی تابش با طول موجهای متناسب ممکن نبوده است. اختراع رادار در سالهای جنگ (45 - 1938) راه ورود به نواحی امواج خیلی کوتاه رادیویی یا کهموج را باز کرد، در حالی که در همان زمان طیف شناسان فروسرخ دامنه فعالیت خود را تا به نواحی طول موجهای بلندتر توسعه میدادند. این دو ناحیه هم اکنون ابعاد کوچکتر از میلیمتر روی هم میافتند.
- گاف طول موج کوتاه ، بخاطر جالب بودنش برای متخصصین فیزیک پلاسما و اختر فیزیک به خوبی پر شده است. هم اکنون حدود طیف نمایی نوری به زیر 2 آنگستروم رسیده است در حالی که مرز پرتوهای ایکس نرم تا 50 آنگستروم میرسند. تشخیص بین پرتو نوری و پرتو ایکس ، در ناحیه پوشش فوق الذکر بر منشأ خطوط طیفی مبتنی است.
- طیف نمایی نوری با گذارهای الکترونهای خارجی یا ظرفیتی و طیف نمایی اشعه ایکس با گذارهای الکترونهای داخلی مربوط میکند. طیفهای نوری ، طول موجهای خیلی کوتاه از الکترونهای خارجی عناصری با درجه یونش بسیار بالا بوجود میآیند.
 |
کاربردهای امواج الکترومغناطیسی
- کاربردهای امواج الکترومغناطیسی در مخابرات: از این جمله میتوان فیبر نوری ، دستگاه رله تلفن ، موجبرها ، ماهواره و ... اشاره کرد.
- کاربردهای امواج الکترومغناطیسی در نظامی: مانند بمب الکترومغناطیسی ، انواع رادار ، ردیابهای موشک و ... .
- کاربردهای امواج الکترو مغناطیسی در پزشکی: از قبیل عکسبرداری مغناطیسی ، رادیولوژی ، سونوگرافی با لیزر ، کاربرد اشعه ایکس و گاما در فیزیک پزشکی و ... .
- کاربردهای امواج الکترومغناطیسی در صنعت: انواع برشکاریهای لیزری ، قطار الکترومغناطیسی و صندلی مغناطیسی و ... .
- کاربردهای امواج الکترومغناطیسی در اخترشناسی: با مطاله طیف الکترومغناطیسی گسیل شده از جو میتوان به ساختار اجرام آسمانی پیبرد.









 1xbet is a scam site
1xbet is a scam site شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی
شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی