سرعت واکنش :
عبارت از تغییر غلظت هر یک از مواد اولیه یا مواد حاصل نسبت به زمان انجام واکنش است
1- اندازه گیری سرعت واکنش بین ید و استون:
2- بررسی بعضی از عوامل مؤثر بر سرعت واکنشهای شیمیایی: مانند غلظت و کاتالیزور
سرعت واکنش؟
کمیتی مثبت است که میزان تغییر غلظت یکی از واکنش دهنده ها یا محصول واکنش را نسبت به واحد زمان (ثانیه، دقیقه، ساعت و ... ) نشان می دهد.
عوامل مؤثر بر سرعت واکنش:
1- نوع واکنش دهنده
2- غلظت واکنش دهنده ( با افزایش غلظت، سرعت افزایش می یابد )
3- دما (افزایش دما باعث افزایش سرعت می شود ،گاهی با افزایش 10 درجه، سرعت 2 تا 3 برابر می شود ) دما روی k تاثیر دارد ، روی سرعت هم تاثیر می گذارد.
K= ثابت سرعت ؛ A= فاکتور فرکانس؛ = انرژی فعالسازی
R= ثابت جهانی گازها؛ T= دما ( کلوین )
4-کاتالیزور ( در وجود کاتالیزور واکنش با سرعت بیشتری انجام می گیرد )
مثالهایی از واکنش های فوق سریع :
تشکیل رسوب نقره کلرید به هنگام مخلوط شدن محلولهای حاوی یون های کلرید و نقره
تشکیل آب به محض مخلوط شدن محلول های اسید و باز در معادله ی شماره ی(2) و نشانه ی غلظت مولی واکنش دهنده های A و B است.
K ثابت سرعت واکنش (rate constant ) نامیده می شود.
m و n مرتبه ی واکنش نسبت به واکنش دهنده های A و B است.
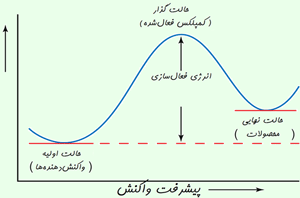
انرژی فعالسازی واکنش :
حداقل انرژی لازم برای فراهم کردن کمترین تحرک واکنش دهنده ها در شروع واکنش است. رابطه ی بین K ( ثابت سرعت ) ، ( انرژی فعالسازی ) و T ( دما به
درجه ی کلوین ):
(3)اگر R ( ثابت گازها ) را برابر 8.314
J/mol .k در معادله ی (3) قرار دهیم، بر حسب J/mol محاسبه خواهد شد. در عمل با اندازه گیری k یک واکنش در دماهای مختلف می توان آن واکنش را از روی منحنی به دست آورد.
در این آزمایش سرعت واکنش بین ید و استون ( واکنش 1 ) را اندازه گیری می کنیم. سرعت این واکنش علاوه بر غلظت ید و استون به غلظت یون هیدروژن نیز بستگی دارد. بر طبق معادله ی (2) رابطه ی سرعت برای این واکنش عبارت است از :
m و n و p مرتبه ی واکنش نسبت به استون، ید و یون هیدروژن است.
مرتبه ی کل واکنش = m + n + p
سرعت این واکنش از تغییرات غلظت به مدت زمان تغییر غلظت به دست می آید.
اگر t زمان لازم باشد تا رنگ محلول مربوط به غلظت اولیه ناپدید شود، سرعت واکنش با استفاده از معادله ی (5) برابر خواهد شد با :
غلظت اولیه ی ید است.
می توان سرعت واکنش را با تغییر دادن غلظت موارد اولیه تغییر داد.
برای مثال اگر غلظت اولیه ی استون را نسبت به مخلوط شماره ی (I) دو برابر کنیم، اما غلظت ید و را ثابت نگهداریم، معادله ی سرعت برای مخلوط شماره ی (II) تغییر خواهد کرد. معادله ی (7ب ) معادله ی سرعت را برای مخلوط شماره ی (II) نشان می دهد :
تاثیر سرعت روی غلظت با استفاده از روابط ریاضی:
از تقسیم دو رابطه ی (7) بر یکدیگر می توان m ( مرتبه ی واکنش نسبت به استون ) را بدست آورد :
با اندازه گیری سرعت واکنش در مخلوط های (I) و (II) می توان نسبت سرعت ها را که مساوی است پیدا کنیم. سپس معادله را برای محاسبه ی m از طریق لگاریتم حل می کنیم. اگر نسبت عددی را برابر Y فرض کنیم، جواب آن بدین شکل است :
به روش مشابه نیز می توانیم مرتبه ی واکنش را نسبت به غلظت یون و تعیین کنیم. سپس با داشتن مرتبه ی هر واکنش دهنده، غلظت آنها و سرعت واکنش و K را بدست آوریم.
می دانیم هرچه زغال نیم افروخته رابیش تر باد بزنیم بر شدت سوختن آن می افزاییم همچنین اگر تکه ای از فلز روی را در اسید هیدرو کلریک 6 مولار حل کنیم واکنش انحلال سریعتر از زمانی رخ میدهد که همین مقدار روی را در اسید هیدروکلریک 1 مولار حل نماییم این ها نمایانگراثر غلظت بر سرعت واکنش هستند وقتی غلظت یکی از واکنش دهنده ها را زیاد می کنیم تجمع مولکولها در واحد حجم بیشتر می شودو عده کل برخورد ها در واحد زمان افزایش می یابد در نتیجه سرعت واکنش زیاد می سود واکنش A + B -----> C + D را در نظر بگیرید . اگر فرض کنیم این واکنش بنیادی بوده ودر یک مرحله صورت می گیرد می توان گفت سرعت واکنش هم با غلظت واکنش دهنده A و هم با غلظت واکنش دهنده B رابطه مستقیم دارد یعنی :
سرعت é [ A ]
سرعت é [ B ]
اگر این دو عبارت را در یک عبارت خلاصه کنیم
سرعت é [ A ] . [ B ]
با ضرب در یک عدد ثابت این تناسب به تساوی تبدیل می شود
ثابت تناسب K ثابت سرعت نامیده میشود
به طور مشابه واکنش زیر را در نظر بگیرید
بنابراین میتوان نتیجه گرفت ضریب یک ماده در معادله موازنه شده یک واکنش بنیادی در عبارت سرعت توان قرار می گیرد
عبارت سرعت برابر است با aA + bB ----> cC + dD پس برای واکنش
سرعت = K . [ A ]a . [ B ]b
از جهتی دیگر وبراساس احتمال برخورد های مولکولی نیز همین نتیجه قابل دستیابی است .
واکنس های غیر بنیادی واکنش هایی هستند که در یک مرحله صورت نمی گیرند واز جمع چند واکنش بنیادی حاصل می آیند به طور مثال اگر واکنش A + B -----> C + D بنیادی نباشد می توان مکانیسم انجام آن را مطابق زیر فرض کرد :
واکنش های دو یا چند مرحله ای به طور معمول با سرعت برابر انجام نمی شوند و معمولا یکی از آنها کند و بقیه سریع صورت میگیرند . بنابراین در این نوع واکنش ها ، واکنش کند تعیین کننده سرعت واکنش است. از این رو در این نوع واکنش ها تنها غلظت واکنش دهنده هایی که در مرحله کند مشارکت دارند در سرعت واکنش موثر است و غلطت سایرواکنش دهند ها تاثیر آنقدر کمی دارد که به طور تقریبی می توان تاثیر آنها را ناچیز گرفت . هرچه اختلاف انرژی فعالسازی مرحله کند با انرژی فعالسازی مرحله یا مرحله های سریع بیشتر باشد تاثیر غلظت واکنش دهنده های مرحله های سریع در سرعت کلی واکنش کمتر می شود
پس در حالت کلی برای واکنش aA + bB -----> cC + dD باید
عبارت سرعت را چنین نوشت :
= K . [ A ]m . [ B ]n سرعت
اگر m=a و n=b باشد به احتمال زیاد واکنش بنیادی است ولی نمی توان مطمئن بود چون ممکن است واکنش غیر بنیادی باشد ولی در مرحله کند واکنش دهنده های واکنش اصلی با همان ضرایب مشارکت داشته باشند مانند واکنش فرضی زیر :
ولی اگر m # a و یا n # b باشد می توان مطمئن بود که واکنش بنیادی یا چند مرحله ای است
بدیهی است که m و n می توانند صفر باشند مثلا اگر m صفر باشد به این معنااست که سرعت واکنش نسبت به تغییر غلظت A تغییر نمی کند به عبارت بهتر در مرحله کند یا مرحله تعیین کننده واکنش گر
Aهیچ نقشی ندارد
یعنی سرعت واکنش نسبت به A از مرتبه 1 و نسبت به B از مرتبه صفر است مرتبه کلی واکنش برابر مجموع توانهای غلظت مواد در عبارت سرعت است مثلا اگر عبارت سرعت یک واکنش مطابق زیر باشد :
= K . [ A ]m . [ B ]n سرعت
سرعت نسبت به A از درجه mو نسبت به B از درجه n بوده و مرتبه کلی واکنش برابر m+n است
در عمل برای آنکه معین کنند سرعت یک واکنش به غلظت واکنش دهنده ها از مرتبه چند وابسته است آزمایش انجام میدهند به این صورت که طی چند مرحله آزمایش غلظت واکنش دهنده ها را تغیر داده واز روی تغییرات سرعت به چگونگی تاثیرواکنش دهنده ها پی می برند به طور مثال برای واکنش زیر طی چند مرحله آزمایش نتایج زیر حاصل شده است
روش کار :
ابتدا درهرمرحله مقدارپتاسیم یدات وآب مقطر رادرارلن بریزید،سپس بااضافه کردن مقدار سولفیت سدیم(نشاسته)کرنومترراآغاز وباکدر شدن محلول(نشانه پایان واکنش)کرنومتررامتوقف وزمان رایادداشت کنید.این کاررابرای مراحل با غتظت های متفاوت پتاسیم یدات انجام دهید ونتایج رایادداشت کنید





 1xbet is a scam site
1xbet is a scam site شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی
شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی خواص عنصر ها
خواص عنصر ها