انرژی لازم برای جداکردن الکترون از یک ذره گازی شکل است .
اما انرژی n امین یونش ، انرژی لازم برای جداکردن یک مول الکترون از ذره گازی گازی شکل و تشکیل یون
است . در یک شکل ساده می توان انرژی نخستین یونش را تعریف می کنیم : انرژی لازم برای جدا کردن یک مول الکترون از یک مول اتم گازی شکل و تشکیل یک مول یون یک با ر مثبت گازی شکل
اگر بخواهیم روند تغییرات انرژی نخستین یونش را در هر تناوب از جدول بررسی کنیم ، در هرتناوب در حالی که لایه انرژی برای عناصر جدول تناوبی واقع در یک تناوب ثابت است با افزایش پروتون های هسته ، جاذبه هسته بر الکترون لایه ظرفیت بیشتر شده و در نتیجه شعاع اتمی کاهش می یابد در نتیجه انرژی لازم برای جدا کردن الکترون بیشتر خواهد بود . اما در بررسی این روند در دو مورد به بی نظمی یا استثنا برخورد می کنیم .
1 – انرژی نخستین یونش در بریلیم بیشتر از بور
می باشد . در بریلیم ، الکترون از یک زیر لایه پایدارتر و آرایش الکترونی متقارن تر باید جدا شود و این باعث می شود که برای جدا کردن الکترون از اتم بریلیم انرژی بیشتری
باید صرف شود . ولی در آرایش الکترونی بور:
می بینیم که الکترون از زیر لایه پر انرژی و ناپایدار 2P باید جدا شود .
2 – انرژی نخستین یونش در نیتروژن بیشتر از اکسیژن می باشد .بررسی آرایش الکترونی اتم های نیتروژن و اکسیژن نشان می دهد که در نیتروژن ، الکترون باید از یک آرایش الکترونی پایدارتر و متقارن تر باید جدا شود و این با صرف انرژی بیشتری همراه است . ولی آرایش الکترونی اکسیژن :
در رسم نموداری آرایش الکترونی آن می بینیم که در بین دو الکترون با
دافعه وجود داشته و در نتیجه جداکردن الکترون با
راحت تر خواهد بود . اما در نیتروژن ،پایداری الکترون با
بیشتر می باشد .
در تناوب سوم نیز دقیقا به همین دلیل ، این به هم ریختگی درروند انرژی نخستین یونش وجود دارد به طور که انرژی نخستین یونش : و
خواهد بود .
اما در تناوب چهارم به دلیل این که عناصر 21 تا 30 ( اولین سری واسطه های خارجی ) در زیر لایه d الکترون گیری کرده و درون سازی می کنند ، مشاهده می کنیم که این بی نظمی در بین کلسیم و گالیم وجود دارد .اما در بین سلنیم و آرسنیک به چشم نمی خورد . ( انرژی نخستین یونش : ،
)
در بین انرژی های یونش یک اتم ، دچار تفاوت عمده و کوچکی می شویم که از تفاوت عمده ، تحت نام « جهش بزرگ » و از تفاوت کوچک با نام « جهش کوچک » انرژی یونش یاد می کنیم
جهش بزرگ انرژی یونش زمانی رخ می دهد که لایه انرژی عوض شده و بخواهیم از لایه ای نزدیک تر به هسته e جداکنیم که در این حالت مجبوریم با صرف انرژی بیشتری عمل یونش الکترون را انجام دهیم . با یک قاعده سر انگشتی می توان گفت که اگر انرژی یونش الکترونی حداقل 2/5 الی 3 برابر انرژی یونش قبلی شود گوییم که دچار جهش بزرگ انرژی یونش شده است .( بیان این که تعداد ارقام انرژی یونش تغییر کند ، چیز جالبی نیست و به بن بست می خورد . ) اما در خصوص جهش کوچک ، می توان دو حالت را در نظر گرفت : آ ) تغییر زیر لایه باعث ایجاد جهش کوچک انرژی می شود . یعنی الکترون را از 3P کندیم و بخواهیم الکترون بعدی را از 3S جداکنیم . از آن جایی که می دانیم پایداری 3S از 3P بیشتر است ، این اختلاف پایداری باعث تفاوت در یونش الکترون واقع در آن می شود .
ب ) اگر بخواهیم الکترون را از یک آرایش الکترونی پایدارتر جداکنیم ، این می تواند باعث بروز جهش کوچک در انرژی یونش شود ( مثال در اتم اکسیژن که بین و
جهش کوچک انرژی دارد )
روند تغییرات انرژی یونش در یک گروه از جدول تناوبی : در هرگروه از جدول ، با زیاد شدن لایه های الکترونی و زیاد شدن اثر پوششی الکترون های درونی ، جاذبه هسته بر الکترون ها کمتر می شود و از طرفی دافعه الکتروستاتیک الکترون ها بر یکدیگر باعث می شود که الکترون لایه ظرفیت به راحتی یونش یابد . پس انرژی نخستین یونش در هرگروه از بالا به پایین کاهش می یابد .
در هر گروه و حتی در هر تناوب بزرگترین انرژی یونش مربوط به آخرین عنصر خواهد بود چون که تعداد پروتون های بیشتری دارد و جاذبه هسته روی تک الکترون باقی مانده بیشتر خواهد بود . در کل در مقایسه انرژی نخستین یونش ، سعی کنید که با مقایسه شعاع اتمی انرژی های یونش را مقایسه کنید به طوری که هر چه شعاع کمتر ، انرژی نخستین یونش بیشتر خواهد بود تا جایی که می توان گفت انرژی نخستین یونش لیتیم بر خلاف تصور ظاهری ، کمتر از انرژی نخستین یونش آلومینیم
خواهد بود . در صفحه 21 کتاب درسی چاپ 91 ، نمودار انرژی های یونش اتم منیزیم ارائه شده است . وحود دو جهش بزرگ A و C بیانگر تغییر لایه انرژی است که باعث ایجاد تفاوت بزرگ بین دو انرژی یونش متوالی می شود . البته نا گفته نماند که جهش در نقطه A باید بزرگ تر از نقطه B باشد چون که هرچه به هسته نزدیک تر می شویم جداکردن الکترون سخت تر خواهد شد . ذکر یک نکته دیگر ضروری است که در نقطه B جهش کوچک انرژی رخ خواهد داد که در نمودار مشخص نشده است ، هر چند کم ولی شیب نمودار در نقطه B باید از شیب دو نقطه یا الکترون قبل از خود بیشتر باشد . حالا شاید در چاپ های بعدی این کتاب اصلاح شود !!!

چند استثنا در الگوی کلی انرژی اولین یونش
شکل 1 انرژی اولین یونش عناصر در ردیف دوم جدول تناوبی را نشان می دهد. اگرچه انرژی اولین یونش در حالت کلی با حرکت از چپ به راست جدول تناوبی افزایش دارد، اما در این الگو دو تناقض مشاهده می شود:
انرژی اولین یونش بور از بریلیوم کوچک تر است و اکسیژن نیز اولین انرژی یونش کم تر از نیتروژن دارد.
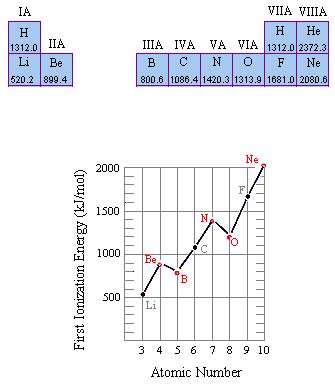
شکل 1: مقادیر انرژی یونش بر حسب تغییرات عدد اتمی
این اثر می تواند با آرایش الکترون در این عناصر توضیح داده شود. زمانی که یک اتم بریلیوم یونیزه می شود، الکترون از اوربیتال 2s بیرون کشیده می شود، اما زمانی که اتم بور یونیزه می شود، الکترون اوربیتال 2p بیرون می آید:
Be: [He] 2s2
B: [He] 2s2 2p1
زمانی که نیتروژن و اکسیژن یونیزه می شوند، الکترون ها باز هم از اوربیتال 2p بیرون کشیده می شوند:
N: [He] 2s2 2p3
O: [He] 2s2 2p4
اما تفاوت مهمی در نحوه ی توزیع الکترون ها در این اتم ها وجود دارد. قاعده ی هوند پیش بینی می کند که هر 3 الکترون در اوربیتال 2p اتم نیتروژن، باید اسپین یکسانی داشته باشند اما در یک اتم اکسیژن، الکترون اضافی در یکی از اوربیتال های 2p جفت می شوند:
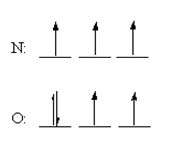
قاعده ی هوند می تواند از این فرض که الکترون ها سعی دارند تا حد ممکن از هم دور باشند تا نیروی دافعه ی بین این دو ذره، کم ترین مقدار را داشته باشد، بهتر درک شود. بنابراین، 3 الکترون در اوربیتال های 2p نیتروژن، وارد اوربیتال های متفاوتی می شوند و اسپین آن ها در جهت یکسانی قرار می گیرد. در اکسیژن، ابتدا 3 الکترون مانند حالت نیتروژن در اوربیتال های متفاوت قرار می گیرند ولی الکترون چهارم باید یکی از اوربیتال های 2p اشغال شده را انتخاب کند.
نیروی دافعه بین این دو الکترون، زمانی کم ترین مقدار را خواهد داشت که این دو الکترون در یکی از اوربیتال ها با هم جفت شوند. با این وجود، هنوز هم مقداری دافعه ی اضافی بین این دو الکترون وجود دارد که این عامل باعث می شود برداشتن یک الکترون از یک اتم خنثای اکسیژن، اندکی راحت تر باشد و این نتیجه با انتظار ما از مؤثر بودن تعداد پروتون های هسته ی اتم مطابقت ندارد.


 1xbet is a scam site
1xbet is a scam site شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی
شیمی کنکور سراسری ۹۳-۱۳۸۵ با پاسخ تشریحی![جزوه آموزش شیمی ۴- بخش ۱ [تهیه کننده: جلال نوری] جزوه آموزش شیمی ۴- بخش ۱ [تهیه کننده: جلال نوری]](http://s3.picofile.com/file/7876987525/shimisalami.jpeg) جزوه آموزش شیمی ۴- بخش ۱ [تهیه کننده: جلال نوری]
جزوه آموزش شیمی ۴- بخش ۱ [تهیه کننده: جلال نوری]